[요약] 숙면을 취하지 못하면 빨리 늙는다? 경험적으로 그럴 듯하지만 과학적인 근거도 있을까? 영국 옥스퍼드 대학교 연구진이 뇌의 잠을 관장하는 회로가 노화와 연관되는 세포의 산화스트레스와 연관된다는 점을 밝혀냈다.(2019.3.)
영국 옥스퍼드 대학교 연구진이 잠과 노화에 공통되는 뇌의 회로를 찾아냈다. 불면증 치료와 노화 연구에 새로운 길을 개척할 연구로 평가된다.
연구팀은 지난 21일 산화스트레스가 어떻게 잠을 부르는지에 대한 기제를 밝힌 논문을 과학 저널 ‘네이처(Nature)’에 실었다. 산화스트레스는 우리가 늙고 퇴행성 질병에 걸리게 되는 주 원인으로 지목되기도 한다. 우리가 어떻게 잠드는지는 아직도 과학적으로 명확히 밝혀지지 않았다. 이 연구결과는 수면 장애 치료에 새로운 희망을 불러오는 한편, 왜 상습적인 수면 부족이 수명을 단축시키는지에 대한 구체적인 근거를 밝히는 데도 도움을 줄 전망이다.
연구를 이끈 옥스퍼드 ‘뇌 회로와 행동 센터’(Centre for Neural Circuits and Behaviour)의 지로 마이센뵉(Gero Miesenböck) 교수는 “산소 탱크에 ‘통제되지 않은 연소는 위험하다’는 문구가 붙어 있는 건 탱크에만 적용되는 말이 아니다. 사람을 포함한 동물도 숨 쉬는 산소로 음식을 에너지로 바꾸는 작용을 불완전하게 할 경우 문제가 생기는 것이다. 불완전 연소는 세포에 ‘산화스트레스’를 가져오게 된다. 이는 노화의 원인일 뿐 아니라 만년을 힘들게 하는 퇴행성 질병의 주범이다. 우리 연구는 산화스트레스가 잠을 통제하는 뉴런을 활성화 시킨다는 것을 보여준다”고 말했다.
연구진은 초파리를 대상으로 실험을 했다. 초파리는 약 50년 전 ‘생체시계’에 대한 통찰을 과학자들에게 처음 제공해준 동물이기도 하다. 파리는 잠을 조절하는 특별한 뉴런들의 세트를 가지고 있는데, 이는 다른 동물이나 사람도 마찬가지일 것으로 추정된다. 마이센뵉 교수 연구팀은 지난 연구에서 이 수면 조절 뉴런들이 켜고 끄는 스위치 같이 작동한다는 점을 발견했다. 즉 이 뉴런들이 전기적으로 활성화 되어 있으면 파리는 자고, 활성화 되어 있지 않을 때는 파리가 깨어 있는 것이다.
이번 논문의 공동 주저자이자 마이센뵉 교수 연구실의 학생이었던 송서호 박사는 “우리는 수면 조절 뉴런 스위치를 작동하는 신호를 찾고자 했다. 앞서 연구에서 잘 때와 깨어 있을 때의 가장 큰 차이는 쉐이커와 샌드맨(Shaker and Sandman)이라고 불리는 두 개의 이온 채널로 얼마나 많은 전류가 흐르는가였다. 자는 동안에는 대부분의 전류가 쉐이커로 가는 식이었다”고 설명했다. 이온 채널은 어떤 뇌세포가 서로 소통하는지를 결정하는 전기 펄스를 만들어내고 조절하는 조직을 말한다.
다른 공동 주저자인 아니사 켐프(Anissa Kempf) 박사는 “쉐이커에는 전기적인 작용을 하는 부분 말고 다른 부분이 밑에 달려 있다. 마치 열기구에 달린 곤돌라 같은 부분이다. 이 곤돌라에는 NADPH라는 작은 분자가 타고 있는데 두 개의 화학적 상태 가운데 하나로 전환하면서 쉐이커의 전류를 조절하는 것으로 나타났다. 그런데 이 NADPH의 상태는 세포가 겪고 있는 산화스트레스의 정도에 영향을 받는 것으로 나타났다. 수면 부족은 산화스트레스 정도를 높이는데 그러면 화학적 상태가 변하게 되는 것”이라고 말했다. 즉, 몸을 노화시키는 산화스트레스가 이런 경로를 통해 잠의 회로에도 영향을 미치는 것이다. 연구팀은 실험에서 번쩍이는 빛을 이용해 NADPH 분자의 상태를 변화시키고 이를 통해 파리를 잠재울 수 있다는 것을 보였다.
마이센뵉 교수는 쉐이커에 묶여 있는 NADPH의 화학적 성질을 바꿀 수 있는 약물을 이용하면 강력한 새로운 수면제를 만드는 것이 가능하리라고 본다. 그는 “현재 있는 수면제는 혼돈, 건망증, 중독 등의 부작용이 있다. 우리가 이번에 발견한 메커니즘을 이용하는 약은 이런 부작용을 피할 수 있을 것”이라고 말했다.
(원문: 여기를 클릭하세요~)
아래는 2022년 3월 8일 뉴스입니다~
(원문: 여기를 클릭하세요~)
나이가 들면 잠의 질이 떨어지는 이유

게티이미지뱅크 제공
수면 과학자들은 생체시계의 영향력이 떨어진 결과라고 설명한다. 나이가 들수록 하루 24시간 주기인 각성과 이완 그래프(사인 곡선 같은)의 진폭이 작아진 결과라는 것이다. 밤이 되면 각성도가 급격히 떨어져 잠이 들고 잠든 상태가 아침까지 죽 이어져야 하는데 낙폭이 작아지다 보니 잠들기도 어렵고 쉽게 깬다는 것이다.
그렇다면 각성도 그래프를 그리는 함수는 f(x)=a·sin(2πx/24)로 나타낼 수 있지 않을까(x는 시간(시)). 나이가 들수록 a가 작아져 그래프 진폭이 작아지고 그 결과 낮에 머리가 맑지 않고 밤에는 잠들기 어렵고 중간중간 깬다는 말이다.
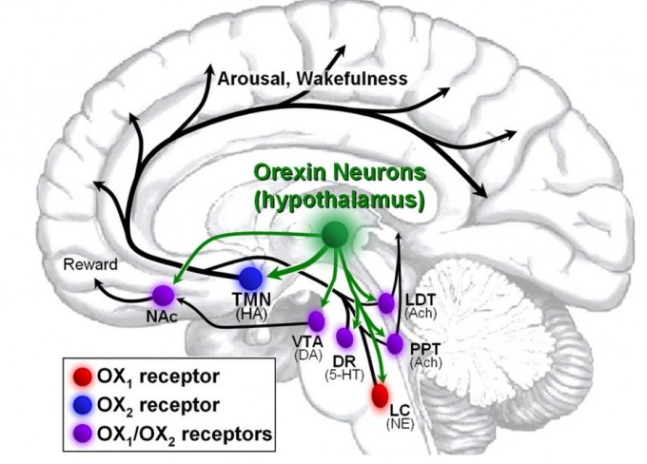
뇌의 시상하부(hypothalamus)에 존재하는 오렉신 뉴런은 각성에 관여하는 여러 부위에 가지를 뻗어 시냅스를 이루고 있다. 오렉신 뉴런이 활성화돼 오렉신을 분비하면 이들 부위가 작동해 뇌가 깨어있게 한다. 약리학 리뷰 제공
흥미롭게도 나이가 듦에 따라 Hcrt뉴런의 수가 줄어든다는 사실이 밝혀졌다. 그 결과 각성 신호 세기가 약해져 낮에 두뇌 회전이 예전만 못하게 된다. 그런데 오렉신만으로는 나이가 들수록 밤에 잠들기 어렵고 자다가 수시로 깨는 현상을 제대로 설명하지 못한다. 각성을 담당하는 Hcrt뉴런의 수가 줄면 잠들고 수면을 유지하는 데 도움이 되면 됐지, 방해하지는 않을 것이기 때문이다. 그렇다면 능동적으로 이완을 일으키는 물질이 따로 있고 오렉신처럼 나이가 들수록 수치가 낮아져 수면 질 저하가 나타나는 걸까.
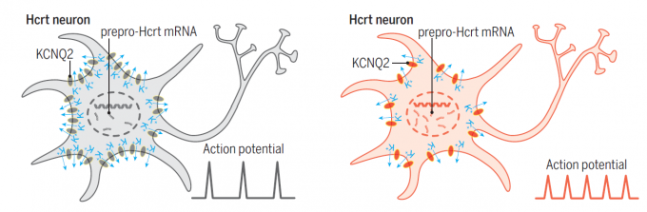
Hcrt뉴런 세포막에는 KCNQ2 포타슘 통로 단백질이 분포해 세포 내부의 포타슘 이온을 바깥으로 내보내 충분한 자극이 있을 때만 활성화될 수 있게 한다(왼쪽). 나이가 들수록 KCNQ2 밀도가 떨어지며 포타슘 이온을 제대로 내보내지 못해 작은 자극에도 활성화되며 시도 때도 없이 오렉신을 분비하고 그 결과 수면의 질이 떨어진다(오른쪽). 사이언스 제공
Hcrt뉴런이 민감해지는 것은 나이가 들수록 뉴런 세포막에 있는 KCNQ 포타슘(칼륨) 통로 단백질이 줄어들기 때문으로 밝혀졌다. 세포막에 이 통로 단백질이 충분히 있어야 정상적인 문턱, 역치(threshold) 이상의 자극에만 반응해 Hcrt뉴런이 활성화돼 각성 신호를 보낸다. 나이가 듦에 따라 KCNQ 단백질 밀도가 낮아지고 그 결과 역치가 낮아져 Hcrt뉴런이 과민해진다는 말이다. 결국 Hcrt뉴런 수가 줄어 어느 순간 분비되는 오렉신의 양은 적어지지만 대신 활성화 빈도는 잦아진다.
‘수면 장애가 있더라도 눈 감고 누워있으면 어느 정도 잠자는 효과가 있는 거 아닌가?’ 수면 장애를 겪어보지 않은 사람은 이렇게 생각할 수도 있겠지만 안타깝게도 깬 상태로 누워 쉬는 것은 결코 수면을 대신할 수 없다.
잠을 왜 자야 하나라는 물음에 대해서는 대사량을 줄여 환경에 적응하는 행동이라는 생태적 관점과 깨어있는 동안 겪은 일들을 편집해 기억으로 저장하는 과정이라는 인지적 설명이 있지만 무엇보다도 뇌가 활동하면서 쌓인 노폐물(주로 변형된 단백질)을 청소하는 시간이라는 게 가장 중요한 이유다.
지난 2013년 뇌의 활동에서 나오는 노폐물을 처리하는 청소 체계인 ‘글림프 시스템’이 발견됐다.
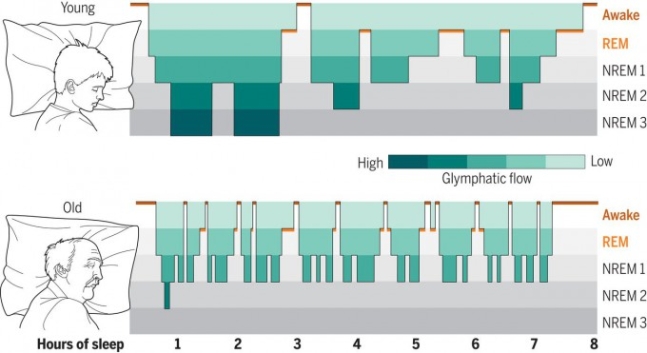
수면의 구조와 수면 단계별 글림프 흐름을 보여주는 그래프다. 젊은이는 잠이 들면 곧 비렘수면 3단계(깊은 수면)에 이르고 뇌척수액이 잘 흐른다(위). 반면 노인은 잠이 들어도 비렘수면 3단계에 이르지 못하고 자주 깬다. 그 결과 뇌척수액의 흐름도 원활하지 못해 뇌에 노폐물이 점점 쌓이게 된다. 청록색이 짙을수록 글림프 시스템이 잘 작동한다는 뜻이다. 사이언스 제공
뇌의 글림프 시스템은 잠을 잘 때 작동하고 깨어있으면 억제된다. 수면 가운데서도 비렘(NREM)수면이 바로 청소 시간이다. 잠이 들면 먼저 비렘수면이 꽤 오래 지속된 뒤 흔히 꿈을 꾸는 시간이라는 렘(REM)수면이 나타난다. 일단 청소부터 해야 한다는 말이다. 전날 잠을 제대로 못 자고 낮에 버티다 밤에 잠이 들면 비렘수면 기간이 늘어나는 것도 청소할 게 많기 때문이다.
안타깝게도 나이가 들어 Hcrt뉴런 개수가 줄어들고 민감해지면 비램수면의 지속시간이 짧아지고 깊이도 얕아진다. 비렘수면은 1단계에서 3단계까지 있고 깊은 잠인 3단계에서 청소 효율이 높은데 나이가 들면 그 단계까지 이르지 못한다. 그 결과 청소가 제대로 이뤄지지 않으면 뇌에 노폐물이 쌓이고 결국 치매나 파킨슨병 같은 신경퇴행성질환에 걸릴 위험성이 커진다. 실제 이들 환자 대다수가 발병하기 수년 전부터 수면 장애로 고생했던 것으로 알려졌다. 노화에 따른 수면 장애는 신경퇴행성질환의 주요 위험 요인이다.
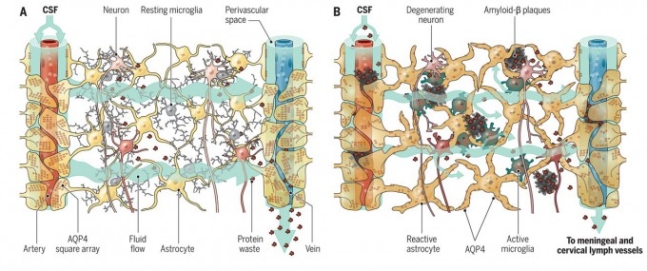
잠이 들면 글림프 시스템이 작동해 낮 동안 활동한 뇌에 쌓인 노폐물을 청소한다. 즉 뇌척수액(CSF)은 정맥(artery)과 별아교세포(astrocyte) 사이의 공간으로 흐르며 뇌세포 사이의 공간으로 침투해 노폐물을 쓸고 가 정맥(vein)과 별아교세포 사이의 공간으로 들어가 뇌 밖으로 빠져나간다(왼쪽). 나이가 들어 수면 장애로 글림프 시스템이 부실해지면 아밀로이드베타(amyloid-베타) 같은 노폐물 덩어리가 쌓이고 미세아교세포(microglia)가 활성화돼 염증반응이 일어나 결국 뉴런이 죽는다. 그 결과 알츠하이머병 같은 신경퇴행성질환으로 이어질 수 있다(오른쪽). 사이언스 제공
앞서 언급했듯이 Hcrt뉴런은 각성에 관련된 부위로 축삭돌기를 뻗어 그 부위의 뉴런과 만난 시냅스에서 오렉신을 분비한다. 해당 부위의 뉴런에는 오렉신 수용체가 분포한다. 노화로 Hcrt뉴런이 민감해져 밤에도 오렉신을 분비해 수면 장애를 일으키므로 오렉신 수용체를 차단하는 약물을 만들면 이 문제를 해결할 수 있지 않을까. 오렉신 수용체가 제 기능을 못하면 각성 신호가 전달되지 못하기 때문이다.
지난 2월 미국 식품의약국(FDA)은 스위스 제약사 아이도시아가 개발한 불면증 치료제 큐비빅(Quviviq. 성분명 다리도렉산트(daridorexant))을 승인했다. 큐비빅은 오렉신 수용체 길항제라는 새 작용기전의 불면증 치료제다. 오렉신 수용체에 먼저 달라붙어 Hcrt 뉴런에서 분비된 오렉신이 결합하지 못하게 방해해 작용하는 약물이다. 큐비빅은 5월 출시될 예정이라고 한다. 참고로 기존 불면증 치료제는 억제성 뉴런을 활성화하거나 뇌 활동을 전반적으로 떨어뜨리는 작용을 통해 약효를 낸다.
뜻밖에도 큐비빅은 최초의 오렉신 수용체 길항제가 아니다. 지난 2014년 미국 머크의 벨솜라(Belsomra·성분명 수보렉산트(suvorexant))가 처음 승인됐고 2019년 일본 에자이의 데이비고(Dayvigo·성분명 렘보렉산트(lemborexant))가 두 번째로 승인을 받았다.
이들은 기존 불면증 치료제에 비해 효과가 뛰어나고 부작용은 적다고 한다. 단순히 잠이 들게 하는 게 아니라 잠의 구조를 정상화하는 효과가 있어 글림프 시스템이 제대로 작동하게 하는 데 도움을 준다. 불면증 치료와 함께 인지력 저하나 신경퇴행성질환의 위험성도 낮출 수 있다는 말이다. 물론 다른 약이 그렇듯이 오렉신 수용체 길항제도 이런저런 부작용이 있고 모든 유형의 수면 장애에 효과가 있는 것도 아니다.
오렉신 수용체 길항제는 고가라서 그런지 몰라도 2014년 출시된 벨솜라도 아직 국내에 들어오지 않은 것 같다. 문헌을 보면 2020년 출시된 데이비고가 약효와 부작용 측면에서 뛰어난 것으로 보인다. 인구 고령화로 수면 질 저하에 시달리는 사람들이 급격히 늘고 있는 현실에서 이들 신약이 하루빨리 도입돼 삶의 질 향상에 도움이 됐으면 하는 바람이다.
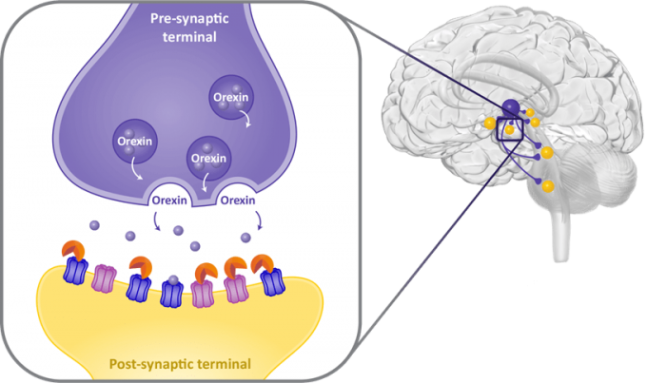
지난 2월 불면증 치료제 큐비빅이 FDA의 승인을 받았다. 오렉신의 각성 신호를 차단해 작용하는 약물로는 세 번째다. 작동 메커니즘을 보여주는 그림으로, 약물(주황색)이 후시냅스 말단 표면의 오렉신 수용체에 먼저 결합해 Hcrt뉴런의 전시냅스 말단에서 방출되는 오렉신이 붙을 자리가 없다. 에자이 제공
