인슐린과 관련된 몇 가지 이야기들
(원문)
92마리째 개의 췌장에서 얻은 인슐린
생물학자, 새 지평을 열다 프레더릭 밴팅
영화 ‘오 브라더스’를 보면 이범수가 조로증에 걸린 12세의 소년 역으로 나온다. 생각은 어린애이지만 특이한 외모와 기묘한 행동으로 인해 종종 이상한 사람으로 오해받는다. 흥신소 직원인 형은 그런 그의 이미지를 이용해 악덕 채무자들을 공포에 떨게 하여 돈을 받아낸다.
이범수가 악덕 채무자들에게 특히 공포스런 이미지를 주는 행동 중 하나는 팔뚝에 주사를 놓는 장면이다. 당뇨병 때문에 시간에 맞춰 꼬박꼬박 인슐린 주사를 놓는 이범수를 보고 채무자들은 히로뽕을 놓는 조폭으로 오인해 기겁을 한다.
오늘날 세계적으로 수많은 당뇨병 환자를 살리고 있으며 현대 의학의 가장 큰 개가라고 일컬어지는 인슐린의 발견은 캐나다의 한 이름 없는 의사이자 생물학자에 의해 이루어졌다.
1920년 10월 30일 저녁, 캐나다 웨스턴 온타리온 대학 의대에서 생리학 조교로 일하던 프레더릭 밴팅은 한 편의 연구논문을 주의 깊게 읽고 있었다. 그것은 췌장의 랑게르한스섬에서 분비되는 물질이 당뇨병과 관계가 있다는 논문이었다.
1889년 독일의 내과의사 민코브스키와 폰 메링이 개에게서 췌장을 떼어내면 당뇨병이 생긴다는 사실을 우연히 발견한 이후 과학자들은 당뇨병 치료의 열쇠가 췌장에 있다고 생각했다. 마침내 1908년 독일의 추엘처는 췌장 추출물을 환자에게 투여하여 당이 약간 줄어드는 효과를 거두었다. 하지만 부작용 때문에 더 이상의 진전은 없었다.
췌장에는 혈당을 줄이는 물질인 인슐린뿐만 아니라 반대로 늘어나게 하는 물질도 포함되어 있기 때문이었다. 그럼 과연 췌장에서 인슐린만을 순수하게 분리해내는 방법은 없을까.
논문을 읽은 그날 밤, 밴팅은 “만일 췌장관을 졸라매어 단백질을 분해하는 효소의 분비를 막는다면 인슐린을 추출할 수 있지 않을까” 하는 아이디어를 떠올렸다. 그는 즉시 웨스턴 온타리오 대학을 찾아가 자신의 실험 아이디어를 설명하고 실험실 사용을 의뢰했다. 하지만 학교 관계자는 그의 제안을 일언지하에 거절했다.
사실 그때 상황에서는 밴팅의 제안을 들어줄 곳이 없는 게 당연했다. 1891년 11월 14일 캐나다의 온타리오주 앨리스톤에서 태어난 밴팅은 1916년 토론토의과대학을 졸업했다. 그 후 군의관으로 육군에 입대하여 제1차 세계대전 때 프랑스 전선으로 파병되었다.
그때 그는 전투에서 부상을 당해 팔을 절단하지 않으면 생명이 위험하다는 진단을 받았다. 그러나 그는 목숨을 걸고 수술을 거부했다. ‘의사로 일하라고 하늘이 내게 준 팔을 자르느니 차라리 팔다리가 있는 채 죽겠다’며 고집을 피운 것이다. 결국 그는 팔을 자르지 않고도 목숨을 건지고 전상자들을 헌신적으로 치료하여 1919년 전쟁공로 십자훈장을 받기까지 했다.
하지만 현실은 그런 그의 고집과 열정과는 사뭇 달랐다. 제대 후 정형외과학을 공부한 그는 캐나다 런던시에서 병원을 개업했다. 그러나 문을 연 지 한 달 동안 그를 찾는 환자는 거의 없었다. 시골 출신의 이름 없는 외지인 의사를 미덥지 않게 보았기 때문이다.
그러다 웨스턴 온타리온 대학에서 짬짬이 강의를 하고 있던 그에게 연구를 쉽게 허락할 리 만무했다. 그는 포기하지 않고 다시 모교인 토론토대학의 문을 두드렸다. 당시 당뇨병 분야의 권위자였던 존 맥클리어드 교수가 그의 목표였다.
밴팅이 세운 가설의 의미를 알아차린 맥클리어드는 그에게 실험실과 실험장비, 실험동물을 제공해주기로 했다. 또 의대 대학원생이던 찰스 베스트를 실험 조교로 동참시켰다.
이렇게 하여 밴팅은 1921년 5월부터 베스트와 함께 연구에 착수하여 개의 췌장관을 졸라매고 며칠 기다렸다가 섬 모양의 반점 부분을 떼어내 분석하고 그 추출물을 실험적으로 당뇨병을 일으킨 개에게 주사하는 실험을 되풀이했다.
맥클리어드가 처음 제공한 개는 10마리였으나, 91마리가 될 때까지 그들은 아무런 결과도 얻지 못했다. 그런데 92마리째의 실험에서 기적 같은 일이 일어났다. 놀랍게도 추출물을 주입받은 개의 혈당치가 떨어지면서 원기를 회복한 것이다.
그 후 연구는 일사천리로 진행되었다. 맥클리어드가 소개한 생화학자 제임스 콜립에 의해 그들은 거의 순수한 인슐린을 분리해내게 되었다. 그리고 당시 토론토대학 병원에 입원 중이던 환자에게 실시한 임상실험에서도 성공적인 결과를 얻었다. 이로써 오랫동안 불치병으로 여겨지던 당뇨병에 대해 치료의 길이 열리게 되었다.
임상실험에서 성공을 거둔 다음해인 1923년 밴팅은 맥클리어드와 함께 이 연구성과로 노벨 생리의학상을 수상하기에 이르렀다. 노벨상의 수상 관례로 볼 때 업적을 이룬 지 2년도 채 안돼 상을 받는 것은 매우 이례적인 일이었다. 그만큼 이들의 업적은 의학적으로나 사회적으로 큰 반향을 불러일으켰다.
하지만 노벨상을 받는 과정에서 한때 밴팅이 수상 거절을 고려할 정도로 잡음이 있기도 했다. 그 원인은 밴팅에게 연구실을 제공해주고 실험에 대한 조언을 하며 연구책임자로 알려져 있던 맥클리어드와의 공동 수상 때문이었다.
사실 밴팅과 맥클리어드 간의 업적 다툼은 노벨상 수상 전에부터 불거져 나왔다. 그것은 1922년 9월 토론토대학에서 두 사람으로부터 발견의 전말과 각자의 역할에 대해 보고서를 제출받은 사실에서도 확인된다.
밴팅의 입장에서 보면 맥클리어드가 연구에 별로 기여한 공로가 없음에도 자기 연구인양 행동하는 것에 대해 불만이 있었다. 또 연구 초기 봉급과 실험실 환경의 개선을 요청했을 때 맥클리어드가 들어주지 않았던 것도 섭섭했다.
이에 대해 맥클리어드는 전혀 다른 입장을 보였다. 밴팅의 아이디어는 전혀 새로운 것이 아니었지만, 자신과의 공동 연구로 새로운 방법을 찾아 연구에 성공할 수 있었다는 주장이었다. 더구나 밴팅의 연구가 단시일 내 전 세계적으로 인정받게 된 것은 맥클리어드의 권위에 힘입은 것이라는 사실도 무시할 수 없었다.
어쨌든 이들의 갈등은 밴팅이 노벨상금을 베스트와 나누어 가지고, 맥클리어드는 콜립과 나누어 가지는 것으로 일단락되었다. 그때 밴팅의 나이가 33세였으니, 당시로서는 가장 어린 나이에 노벨상을 받는 기록을 세웠다.
그의 사회적인 명성 또한 높아져 영국왕 조지 5세는 나이트 작위를 밴팅에게 내렸다. 또 캐나다 정부는 그의 수상을 기려 1천5백 파운드의 연금을 지급했다. 토론토 시민들은 그의 이름을 딴 연구소를 토론토 의과대학에 만들어 그의 업적을 기렸는데, 이 연구소는 지금도 캐나다의 유명 연구소로 손꼽히고 있다.
하지만 노벨상을 받은 후 그의 여생은 그리 순탄한 편이 아니었다. 무엇보다 새로운 연구 업적을 뚜렷이 남기지 못했으며, 생애도 길지 않았다. 제2차 세계대전이 일어나자 밴팅은 다시 자원입대했다. 군에서 대령 계급을 주겠다고 했지만 그는 펄펄 뛰며 일등병을 요구하는 고집을 부렸다. 결국 소령으로 종군해 영국과의 연락 임무를 수행하던 도중 1941년 2월 뉴펀들랜드에서 비행기 사고로 생을 마감했다.
(원문)
인슐린 발견과 상금 분배
노벨상 오디세이
1923년 노벨 생리의학상의 주인공은 인슐린을 발견한 밴팅 박사와 매클라우드 교수로 결정됐다. 캐나다 정부는 밴팅의 수상을 기려 연금 지급을 결정했으며, 그가 인슐린으로 당뇨병 환자를 최초로 치료한 토론토종합병원 앞에는 밴팅연구소가 세워졌다. 또한 당뇨병으로 고생하던 영국 왕 조지 5세는 그에게 기사 작위를 수여했다.
인슐린을 발견해 수많은 당뇨병 환자들을 구한 공로를 생각하면 당연한 일이었다. 그런데 밴팅은 노벨상 수상 후 상금의 절반을 동료인 찰스 베스트와 나누어 갖겠다고 공개적으로 선언하고 즉시 실행에 옮겼다. 그러자 공동 수상자였던 매클라우드 역시 자신의 상금을 인슐린 연구에 참여했던 생화학자 제임스 콜립과 나누겠다고 밝혔다. 도대체 이들에게 무슨 일이 있었던 걸까.
1891년 캐나다 온타리오주의 한 시골마을에서 태어난 밴팅은 어릴 적부터 생물 실험에 관심이 많아 농사를 짓던 아버지의 소가 죽으면 직접 해부하기도 했다. 토론토의과대학을 졸업하고 정형외과 수련의를 거친 그는 토론토에서 약 200㎞ 떨어진 런던시에서 개업했다.
사실 그가 그곳까지 가서 개업한 것은 토론토의과대학에서 연구원 자리를 얻지 못했기 때문이다. 그러나 타지에서 온 시골 출신의 의사가 개업한 병원을 찾는 환자는 별로 없었고, 생계를 위해 그는 틈틈이 그곳에 있던 웨스턴온타리오 대학에서 강의를 해야 했다.
그 무렵 밴팅은 당뇨병의 치료법을 연구하기로 결심했다. 어릴 적부터 단짝이었고 의과대학도 함께 다녔던 친구가 당뇨병에 걸려 서서히 죽어가는 걸 지켜보기 힘들었기 때문이다.
방학 동안 매클라우드 실험실 이용
그는 췌장에 있는 랑게르한스섬에서 분비되는 물질이 당뇨병과 관련이 있다는 사실에 착안해, 개의 췌장관을 묶으면 당뇨병을 치료할 수 있는 물질을 추출할 수 있을지도 모른다는 아이디어를 떠올렸다.
그때까지 많은 이들이 그 물질을 추출하는 데 실패한 이유가 췌장에서 분비되는 트립신 때문일 수도 있다고 그는 생각했다. 트립신은 단백질을 분해하는 효소다. 따라서 췌장관을 묶어 트립신의 분비를 막는다면 랑게르한스섬에서 분비되는 물질도 분해되지 않고 그대로 추출할 수 있다는 게 이 아이디어의 요지다.
그는 자신의 실험 계획을 웨스턴 온타리오 대학에 알리고 실험실 사용을 부탁했으나 거절당했다. 하지만 포기하지 않고 모교인 토론토대학을 찾아갔다. 이때 만난 이가 바로 생리학과 교수인 매클라우드였고, 그는 방학 기간에 빈 실험실의 사용을 허락받았다. 매클라우드는 밴팅의 실험에 회의적인 입장이었지만, 의대생인 찰스 베스트를 조수로 붙여주기까지 했다.
밴팅은 베스트와 함께 개의 췌장관을 묶은 다음 며칠 기다렸다가 랑게르한스섬의 조직을 분석하고 그 추출물을 췌장이 제 기능을 못하는 다른 개에게 주사하는 실험을 반복했다. 하지만 91마리째까지 아무런 결과도 얻지 못했다.
그런데 92마리째 실험에서 기적처럼 성공했고, 그들은 랑게르한스섬으로부터 추출한 물질에 ‘아일레틴’이라는 이름을 붙였다. 섬에서 생성되는 화학물질이라는 의미였다. 이후 아일레틴은 매클라우드의 제안에 의해 같은 뜻의 라틴어인 ‘인슐린’으로 바뀌었다.
밴팅은 인슐린의 효과를 입증하기 위해 도축장을 다니면서 소와 돼지의 췌장을 수집했다. 그 과정에서 실험비가 부족해 자신이 타고 다니던 차를 팔기까지 했다. 밴팅의 실험이 성공할 가능성이 높아지자 매클라우드도 서서히 관심을 보이기 시작했다. 매클라우드는 자신의 연구소에서 일하는 생화학자 제임스 콜립을 밴팅에게 보내 활성물질의 다량 추출을 도왔다.
그들은 당시 개최됐던 미국생물학회에 논문을 제출하기로 했고, 논문 초록 작성을 매클라우드에게 부탁했다. 초록의 제출 시점이 너무 임박했기 때문이었다. 이렇게 해서 자연스레 매클라우드의 이름도 논문에 실리게 됐다.
공동 수상에 대한 우회적인 이의 제기
1922년 1월 13세의 당뇨병 환자에 인슐린을 투여해 최초로 성공적인 치료가 이루어졌으며, 이 성공 소식은 전 세계적으로 큰 관심을 모았다. 그리고 다음해인 1923년에 밴팅과 매클라우드에게 노벨상이 수여된 것이다.
밴팅이 자신의 상금을 베스트와 공개적으로 분배한 것은 사실 매클라우드의 노벨상 공동수상에 대한 우회적인 이의 제기였다. 밴팅은 매클라우드보다 베스트가 자신의 실험에 훨씬 더 많이 기여했다고 생각했다. 사실 매클라우드는 실험의 조직적 측면에서만 기여했을 뿐이다.
하지만 매클라우드의 입장은 달랐다. 독일에서 공부한 영국 출신의 그는 인슐린 발견이 자신의 실험실에서 이루어졌으므로 책임자인 자신의 노벨상 수상이 당연하다고 여겼다. 따라서 그는 강연 등에서도 은연중에 자신이 연구책임자이며 밴팅은 자신의 밑에 있는 연구원일 뿐이라는 요지의 말을 하곤 했다.
어쩌면 당시 학계의 관행이라고 볼 수 있는 매클라우드의 수상에 대해 밴팅이 반기를 든 것은 평소 그의 우직한 성품을 감안할 때 결코 이상한 일이 아니었다. 그는 베스트와 함께 인슐린 제조 특허권을 토론토대학에 사실상 무상으로 양도했다. 그 후 토론토대학은 인슐린 제조권을 제약회사 ‘릴리’에 넘겼으며, 덕분에 인슐린은 1년도 채 되지 않아 당뇨병의 표준 치료법으로 자리 잡을 수 있었다.
밴팅은 토론토 의과대학 재학 중 1차 세계대전이 발발하자 군의관으로 입대해 당시 격전지 중의 하나였던 프랑스에서 활동했다. 그런데 2차 세계대전이 터지자 그는 ‘밴팅 & 베스트 연구소’ 소장 자리를 박차고 다시 자원입대했다가 1941년 뉴펀들랜드의 눈 덮인 산중에 추락해 사망했다.
밴팅은 노벨상을 수상한 최초의 캐나다인이었다. 하지만 그보다는 이 같은 영웅적인 행동 때문에 그는 캐나다에서 아직도 우상으로 남아 있다. 그의 사망 후 밴팅 & 베스트 연구소의 소장 자리는 연구 동료였던 찰스 베스트가 이어받았다.
인슐린의 발견과 세계에 미친 영향 [The Discovery of Insulin and its Worldwide Impact]
이 기록유산은 캐나다 토론토대학교(University of Toronto)에서 소장하고 있는 인슐린의 발견과 관련된 기록물이다. 인슐린의 발견은 20세기에 구현된 가장 중요한 의학적 진보 중 하나이며, 그와 관련된 내용이 수많은 퐁(fond)으로 구성되어 기록물로서 완전하게 남아 있다. 인슐린의 발견과 관련된 기록물 컬렉션에는 프레더릭 밴팅(Frederick Grant Banting, 1891~1941), 찰스 베스트(Charles Herbert Best, 1899~1978), 제임스 콜립(James Bertram Collip, 1892~1965), 존 매클라우드(John James Richard Macleod, 1876~1935)로 이루어진 연구팀이 자필로 기록한 초기 실험에 관해 쓴 원본 메모가 들어 있으며, 성공적인 인슐린 조제법에 대한 내용이 환자 차트, 서류, 보고서, 의사들과 연구자들 및 일라이릴리(Eli Lilly)사 그리고 토론토대학교 사이에 오고간 편지, 환자들의 답장 등의 기록물로 남아 있다.
토론토대학교 의과대학의 연구와 교육은 오랜 역사와 함께 전통적으로 그 위상이 매우 높기 때문에, 이미 이러한 전통을 알고 있는 이들에게는 인슐린의 발견이 토론토대학교에서 이루어졌다는 사실이 그리 놀랄만한 일은 아니었다. 물론 인슐린의 발견이라는 공로는 공식적으로 밴팅, 베스트, 콜립, 매클라우드, 이 네 사람의 과학자들에 돌아가야 마땅하지만 그들이 이룬 위업은 토론토대학교에서 연구에 매진했던 세계 최고 수준의 수많은 연구자들이 이루어 놓은 단단한 연구적 기반 위에서, 그리고 더 나아가서는 전 세계적으로 다른 연구자들이 이룬 연구 성과 위에서 가능한 것이었다.
당시 밴팅 박사의 경우 의학 연구 분야에서의 경험이 일천했던 데 비해서 매클라우드 박사는 밴팅 박사가 제안했던 정확한 절차가 그가 아는 한 당뇨병 연구 분야에서 이전까지 한 번도 시도된 적 없는 새로운 시도였음을 잘 인지하고 있었다. 때문에 설혹 그 결과가 부정적이라 해도 당뇨병 연구에 있어 충분히 가치 있는 시도가 될 것이라 생각했다. 매클라우드 박사는 인슐린에 관한 연구 초기에 밴팅 박사를 도와줄 수 있는 자료를 가지고 있었고, 또한 새로운 아이디어를 시험해볼 의지도 있었다. 인슐린의 발견 이후로도 토론토대학교는 많은 발견을 했지만, 중요도를 따지자면 인슐린의 발견에 견줄만한 업적은 많지 않다. 이러한 사실은 연구에 있어 결과를 짐작할 수 없음에도 새로운 아이디어에 지원하는 것이 얼마나 가치 있는 일인지를 가장 효과적으로 증언하고 있다.
‘토마스 피셔 희귀본 도서관(The Thomas Fisher Rare Book Library)’에는 전 세계에서 인슐린의 발견과 관련된 기록물을 일정한 목적을 가지고 수집한 가장 포괄적인 컬렉션을 보존하고 있다. 기록물 컬렉션 및 웹사이트를 통해서 누구나 공동 발견자들의 연구를 본래의 모습 그대로 상세하고 정확하게 확인할 수 있다. 이토록 많은 관련 자료들을 하나의 기관에서 수집하고, 원본의 모습 그대로 보존하는 것은 흔치 않은 사례이다. 웹사이트는 전 세계 누구라도 자유롭게 방문하여 인슐린의 발견과 관련한 기록물 자료를 볼 수 있는 센터 역할을 하고 있다.
인슐린의 발견에 관한 컬렉션을 알게 된다는 것은 세계 공동체에 값어치를 따질 수 없는 가치를 지니고 있다. 인슐린의 발견은 당뇨병을 앓고 있는 환자들로서는 삶과 죽음을 가르는 경계를 의미한다고 할 수 있다. 인슐린은 또한 다른 질병을 앓고 있는 환자들에게도 훨씬 더 개선된 삶의 질을 제공하고 있다.
인슐린의 발견 이래로 당뇨병 분야에서 이와 견줄만한 새로운 발전은 아직 이루어지지 않았다. 오늘날의 전 세계적인 당뇨병의 확산을 감안할 때 이 자료는 여전히 매우 중요하다. 세계보건기구(World Health Organization)의 자료에 따르면, 2011년 8월 현재, 전 세계적으로 당뇨병 환자는 346,000,000명에 이르고, 2004년 한 해에만, 고혈당으로 인하여 약 3,400,000명이 사망하였다. 당뇨병으로 인한 사망의 80%는 저소득, 또는 중간 소득 국가에서 발생하는데, 인도는 약 50,800,000명의 인구가 당뇨병을 앓고 있는 것으로 추정되어 세계 최대의 당뇨병 인구 국가이고, 43,200,000명의 당뇨환자가 있는 것으로 추정되는 중국이 그 뒤를 잇고 있다.
세계보건기구는 2005년부터 2030년 사이에 당뇨병으로 인한 사망이 두 배로 증가할 것으로 예측하고 있다. 남아프리카공화국에서 진행한 연구 결과에 따르면 확진 판정을 받지 않았지만 당뇨병을 앓고 있는 사람들은 당뇨 환자의 약 85%, 카메룬의 경우 80%, 가나의 경우 70%, 탄자니아의 경우 80% 이상이다. 2010년 당뇨병으로 인한 사망자 수는 2007년의 추정치보다 5.5% 증가하였다. 이런 증가세는 북아메리카와 캐리비안 지역에서의 당뇨병 사망자 수의 29% 증가, 동남아시아 지역에서 12% 증가, 서태평양 지역에서 11% 가 증가한 것이 주된 원인이었다. 인슐린은 세계보건기구가 지정한 필수 의약품 목록(Essential Medicines List)에 포함됨으로써 인슐린 치료에 대해서 공인받았지만 개발도상국의 여러 지역에서는 오늘날까지 여전히 인슐린을 지속적으로 공급받지 못하고 있다.
인슐린이 발견되기 이전에 당뇨병 환자들은 매우 엄격하게 제한된 식단으로 식사를 했으며, 그들 중 대다수는 당뇨병 자체 또는 괴저(壞疽) 감염을 비롯한 합병증으로 인하여 사망했다. 당뇨병은 실명의 최대 원인 중 하나이다. 조기 진단과 치료를 통해서만이 당뇨성 실명을 예방할 수 있다. 저소득 또는 중간 소득 사회에서는 당뇨의 진단과 치료에 있어 시의적절하고 효과적인 접근에 관한 논의가 여전히 진행 중이다. 인슐린의 발견은 전 세계 대학과 연구소, 병원 등에서 지속적인 의학 연구를 후원하는 일이 얼마나 중요한지 강조하고 있다.
밴팅 박사와 매클라우드 박사는 1923년 인슐린의 발견으로 노벨의학상을 수상하였는데, 두 사람 모두 그 상금과 공로를 그들의 공동 연구자 콜립 및 베스트 박사와 공유하였다. 인슐린의 발견은 전 세계에서 지금까지 수백만 명의 생명을 구했고, 앞으로도 그러할 것이다.
세계적 중요성·고유성·대체불가능성
‘인슐린의 발견’ 컬렉션은, 인슐린 발견 당시와 그 직후에 수집한 원본 기록 자료로 되어 있다는 점에서 세계 공동체 차원에서 고유하며 대체불가능하다.
인슐린의 발견은 당뇨병으로 고통 받는 사람들의 생명을 구하고 그들의 삶의 질을 개선했다. 당뇨환자, 그들의 친지, 연구자, 의사, 임상의, 역사학자, 작가, 영화제작자 등에게 있어 이 자료의 중요성은 그 크기를 따지기가 어렵다. 당뇨환자들은 영감을 얻고 상태를 호전시키기 위해 초기에 환자들이 보낸 편지와 차트, 밴팅 박사의 스크랩북과 사진, 그밖에 여러 기록 등 관련 자료를 참고한다. 어느 누군가에게는 당뇨병 증상을 경감할 수 있는 아이디어를 보여주는 색이 바랜 밴팅 박사의 원본 노트를 직접 볼 수 있다는 사실이 매우 감격적인 경험이다. 1920년 10월 31일자로 표시된 페이지에서는 다음과 같이 적혀 있다.
“당뉴병. 개의 췌장관 결찰. 소포가 퇴화하고 랑게르한스섬은 유지될 때까지 개들이 살아 있음. – 개들에게서 내분비를 격리하고 [당뇨] 완화를 위해 노력함.”
밴팅 박사의 원본 노트(1920년 10월 31일자로 표시된 페이지)
‘당뇨병’을 ‘당뉴병’이라고 잘못 쓴 것으로 보아 밴팅 박사는 약간의 난독증을 앓았던 것으로 보인다. 이 자료는 특히 어린이와 그들의 부모에게 위로를 주기도 한다. 당뇨병 분야를 새롭게 전공하는 신참 박사들은 연구의 영감을 얻기 위해 이 자료를 참고한다. 임상의들은 이 기록물 등을 통해 새로운 도전을 받고 영감을 얻고 있다. 인슐린의 발견 이래로 당뇨병 분야에서 이와 견줄만한 새로운 발전은 아직까지 없었다.
오늘날의 전 세계적으로 당뇨병이 확산되고 있음을 감안할 때 이 자료는 여전히 지극히 중요하다. 인슐린의 발견은 전 세계에서 지금까지 수백만 명의 생명을 구했고, 앞으로도 그러할 것이다. 컬렉션에 포함된 원본 기록물 문서 중에서는 1923년 밴팅 박사와 매클라우드 박사에게 노벨의학상의 영예를 안겨준 연구 자료가 포함되어 있다. 두 사람 모두 그 상금과 공로를 그들의 공동 연구자 콜립 박사 그리고 베스트 박사와 함께 나누었다. 이 컬렉션은 토론토대학교(University of Toronto)의 토마스 피셔 희귀본 도서관(Thomas Fisher Rare Book Library)에 소장되어 있다.
‘인슐린’에 관한 나무위키의 내용 – 2018년 9월 19일
1. 개요
2. 설명
인체 내에서 분비되는 호르몬의 일종으로, 최연소 노벨 생리의학상을 받은 캐나다인 프레더릭 벤팅이 발견했다.
혈중에 분포하는 포도당을 글리코겐으로 바꾸어 세포에 저장[2], 세포가 사용함으로써 혈당량을 낮추는 역할을 한다.[3] 그래서 여러 모로 유명한 호르몬인데, 이게 부족하거나 수용체에 문제가 생기면 혈당량 조절에 문제가 생기게 되고, 그 유명한 당뇨병에 걸리게 된다. 반대로 이게 너무 많이 나오면 과체중 문제가 생기거나 저혈당증에 걸린다.
혈당을 올리는 호르몬은 여러 종류임과 달리[4] 혈당을 낮추는 호르몬은 인체에서 인슐린이 유일하다.즉 혈당이라는 항상성을 유지할 수단이 하나밖에 없다는 것. 그럴 수밖에 없는게 고혈당으로 인한 당뇨병은 신체가 서서히 망가지게 하는 반면, 저혈당으로 인한 쇼크는 일순간에 생명을 위협하기 때문이다. 저혈당이 발생하면 인체는 비상상황이 발생한 것으로 간주해서 모든 수단을 강구해서 혈당치를 올린다. 전력난으로 인한 블랙아웃을 생각해보면 대충 비슷하다. 이런 특성은 인류가 빙하기에 적응하는 과정과도 연관성이 깊다.
저항성이나 수용체 감소가 원인인 2형 당뇨병라든가, 영향불균형이 원인으로 추측되는 1.5형 당뇨병과는 달리 1형 당뇨병은 바로 이 호르몬을 분비하는 베타세포를 신체에서 적으로 간주해 죽여버리기 때문에 발생한다. 따라서 1형 당뇨병은 자가면역질환이다. 하지만 때때로 자가항체반응이 없음에도 1형 당뇨병이 오는 경우가 있는데 이를 특발성 당뇨병이라고 한다. 즉 1형 당뇨병도 1A형 당뇨병(자가면역성)과 1B형 당뇨병(특발성) 두가지로 나뉜다. 자세한 것은 1형 당뇨병 항목 참조.
현재 처방전을 가진 환자나 의료인에 한해 약국에서 주사기의 형태와(펜형) 병의 형태로(바이알형) 판매한다. 혈당이 높은 당뇨환자에게는 약이겠지만 정상인에게는 독이다. 즉 인슐린이 체내에 과다하게 되어 저혈당이 올 수 있다.[5] 물론 환자들도 양 조절에 실패하면 저혈당이 온다.
더불어 혈당을 낮추기 위한 작용과 함께 여러 동화 작용도 같이 한다. 기작은 꽤나 복잡하여 이해하기 쉽게 설명하기 어려워 넘어가지만, 대충 살을 찌우는 역할을 한다는 뜻. 혈중 포도당을 글루코겐으로 합성하여 저장하는 동화작용을 하면서 동시에 지질이나 단백질을 합성하여 각 조직에 저장하는 역할도 동시에 한다. 일단 혈중에 있는 에너지원으로 사용 가능한 물질들을 거의 저장 하는 기능이라고 이해하면 간단하다.
이를 이용하여 보디빌더(로이더=금지약물을 사용하는 사람들)들이 도핑으로 근육을 만드는데 사용하기도 한다. 운동 후 과량의 단백질을 먹은 후 인슐린을 주사로 넣게 되면 인슐린들의 동화작용으로 근육이 더욱 커지게 되는 것. 이들에겐 부작용[6]으로 저혈당 쇼크가 일어나기도 하는데, 그래서 인슐린 주사를 맞은 후엔 항상 포도당 수용액을 상비하여 저혈당 쇼크를 방지한다. 다른 스테로이드들도 많은데, 인슐린을 사용하는 이유는 당뇨병은 흔한 질병이기 때문에 대량생산에 의한 원가절감으로 비교적 싸고 쉽게 구할 수 있기 때문이다. 다만 지방도 같이 합성되어 비시즌에 벌크업에 많이 사용하며 기본적으로 다른 여러 불법 약물들과 섞어서 효과를 높이는 용도로 사용한다. 다만 이렇게 근육을 만들게 되면 근육이 커지긴 하지만 인슐린 저항성이 커지기 때문에 필연적으로 당뇨병에 걸리게 된다. 탄수화물을 극단적으로 제한하여 섭취하고 체지방를 한자리수로 만들었지만 역설적이게도 당뇨병에 걸린 보디빌더들이 많다.
병도 병이지만 현재 고등학교 생물1에 작지 않은 비중으로 등장하기 때문에 생물을 배우는 대부분의 이과생들은 이 항목의 내용들을 대부분 알 것이다.
사실 글루카곤보다는 이 호르몬이 당뇨병과 연관되다보니 훨씬 더 유명하지만 글루카곤이 오늘의 토막글로 선정되면서 문서량이 훨씬 더 많아진 적이 있었다. 2018년 이후로는 역전되어 인슐린의 문서량이 더 많다.
3. 제품
당뇨병 치료를 위한 의약품으로서의 인슐린의 개발역사는 아래와 같다.
1920년대에 캐나다에서 최초로 소의 인슐린으로 사람을 치료하는데 성공.
1930년대 이후 덴마크의 노보-노디스크사에서 주도적으로 돼지와 소의 췌장에서 인슐린을 분리한 후 각종 첨가제로 개량하여 시판.
1955년 영국의 프레데릭 생거가 인간 인슐린의 아미노산 서열을 규명하고 그 공로로 노벨상을 수상.
1969년 영국의 도로시 호지킨 여사가 x-ray 결정학 기법으로 인슈린 분자의 3차원 구조를 규명.
1978년에 미국의 바이오텍 회사 제넨테크에서 유전자재조합(유전공학)기술을 이용하여 인간인슐린을 인공적으로 합성했다.
1983년 미국의 제약사 일라이-릴리에서 제넨테크의 특허를 사들여 휴물린이란 브랜드명으로 시판하기 시작했다.
2000년대 들어 유럽 제약사 사노피-아벤티스에서 란투스와 애피드라 등 약효지속시간에 차별화를 둔 변형 인슐린을 개발하여 판매하기 시작했다.
2017년 현재는 주사가 아닌 알약으로 복용 가능한 인슐린이 임상2상을 통과했다. 이제 다규모 임상3상만 통과하면 신약으로 신청 가능하다. 이외에도 일주일간 효과가 지속되는 인슐린과 피부부착식 패치를 이용한 인슐린도 임상시험 중.
4. 제품화된 인슐린의 종류
현 시점에서 제품화된 인슐린은 작용시간과 작용패턴에 따라서 몇 가지 종류로 구분된다.
4.1. 초속효성
말 그대로, 듣기 시작하고 안 듣기 시작하는 시간이 가장 빠른 인슐린이다. 인슐린의 일부 아미노산 배열을 바꾸어 빨리 듣게 한 것으로 주사 후 5~15분 안에 듣기 시작해 늦어도 1시간까지만 효과가 있다. 인체에서 자연 분비되는 인슐린과 가장 비슷한 작용패턴을 갖고 있기에 피하주사와 함께 인슐린 펌프에도 사용되는 인슐린이다. 식사 직전 또는 직후에 주사하며 맑은 액체 형태이다. 이 형태의 인슐린으로는 휴마로그(일라이릴리, 인슐린 라이스프로), 애피드라(사노피, 인슐린 글루리신), 노보래피드(노보노디스크, 인슐린 아스파트)이 있다.
4.2. 속효성(R)
초속효성보다는 늦고 오래 가지만 빨리 듣는 인슐린이다.주사 후 30분 정도 뒤부터 듣기 시작해 3~6시간 정도 효과가 있다. 레귤러 인슐린이라고도 하며 가장 오래 된 형태의 인슐린으로 초기에는 동물 췌장에서 추출했으나 지금은 유전자재조합 효모균을 통해 대량생산하고 있다. 의사 처방에 따라 인슐린펌프에 사용할 수 있다. 식사 30~45분 전에 주사하며 응급 고혈당 상황에서는 정맥주사할 수도 있다. 맑은 액체 형태이다. 이 형태의 인슐린으로는 휴물린 R(일라이릴리), 노보린 R(노보노디스크)이 있다.
4.3. 중간형(NPH)
늦게 듣고 오래 가는 인슐린이다. 주사 후 1~4시간 정도 뒤부터 듣기 시작해 12~20시간까지 효과가 있다. 의사 처방에 따라 다르지만 1일 1회 주사의 경우 아침 식전에, 1일 2회 주사의 경우 아침과 저녁 식전에 주사한다. 하얀 현탁액 형태여서 주사 전에 반드시 흔들어서 주사해야 한다. 이 형태의 인슐린으로는 휴물린 N(일라이릴리), 노보린 N(노보노디스크)이 있다.
4.4. 장시간형
중간형 인슐린과 작용시간은 비슷하지만 인슐린의 일부 분자구조를 변화시켜 장시간 작용하되 완만하게 작용하도록 만들어진 것이다. 중간형 인슐린의 농도가 천장을 찍을 때 발생하는 저혈당 위험이 감소하며 중간형 인슐린으로 부족했던 공복혈당 조절능력이 좋다는 장점이 있다. 주사 후 1~2시간정도 뒤부터 듣기 시작해 최장 24시간까지 효과가 있다. 이 형태의 인슐린은 다른 인슐린과 섞어서 쓸 수 없기에 주의해야 한다. 식사와 관계없이 하루 중 일정한 시각에 주사한다. 맑은 액체 형태이다. 이 형태의 인슐린으로는 란투스, 투제오(사노피, 인슐린 글라진), 레버미어(노보노디스크, 인슐린 디터머), 트레시바(노보노디스크, 인슐린 데글루덱)가 있다.
4.5. 혼합형
R형과 NPH형 인슐린을 혼합했거나 초속효성 인슐린의 일부를 프로타민 단백질과 결합시켜 중간형으로 전환한 것이다. 이 형태의 인슐린은 속효성이나 초속효성 인슐린이 빠르게 작용해 식후혈당을 조절하고, 중간형 인슐린이 지속적으로 작용하면서 공복혈당을 조절할 수 있다. 특히 초속효성 인슐린을 사용한 혼합형 인슐린은 빠른 식후혈당 조절기능이 있어서 최근에 많이 사용된다. 중간형 인슐린과 같은 하얀 현탁액 형태이다. 이 형태의 인슐린으로는 휴물린 70/30(속효성, 일라이릴리), 휴마로그믹스 50(초속효성, 일라이릴리), 노보믹스50, 노보믹스30(초속효성, 노보노디스크)가 있다.
5. 인슐린 주사요법의 주의점
요즘 인슐린은 예전과는 다르게 혼자서도 주사하기 편하게 만들어져 나온다. 하지만 사소한 주의사항을 잘 지켜야만 안전하고 편하게 사용할 수 있다. 몇 가지 주의점을 알아보면,
- 펜주사기 사용 방법을 철저히 지도받을 것. 특히 용량조절 방법은 모르면 알 때까지 반복해서 물어보고 아예 몸으로 기억하는 것이 좋다. 최근 나오는 펜주사기(플렉스펜, 플렉스터치, 솔로스타, 퀵펜)들은 용량설정이 잘못되어도 반대로 돌리면 다시 설정할 수 있다. 사용방법은 인슐린을 처음 처방받았을 때 병원의 담당간호사가 매우 자세히 지도해 줄 것이다. 제조사 홈페이지에 동영상으로 설명도 되어 있으니 참고하자.
- 주사부위는 매일 다르게 할 것. 인슐린 주사는 피하주사다. 피부 아래의 진피층에 주사를 놓는데 한 부위에만 반복하여 주사맞을 경우 주사 부위가 모여서 굳어지는 경결과 같은 부작용이 생기고, 당연히 더 아프고 잘 듣지도 않게 될 수 있다. 주사방법을 지도받을 때 언제 어디에 주사 맞았는지 체크할 수 있는 주사부위 체크표를 받을 수 있으니 꼭 챙겨두자.
- 주사용품, 특히 주사바늘은 한 번만 쓰고 버릴 것. 주사바늘을 반복적으로 사용하는 것은 위생 상 좋지 않을뿐더러 무뎌진 주사바늘 끝 때문에 더 아프고 불쾌할 수 있다. 주사바늘을 버릴 때는 꼭 바늘통과 덮개를 같이 씌워서 단단한 용기에 버려야만 버리는 과정에서 다른 사람이 다치는 것을 막을 수 있음을 유념하자.
- 여러 가지 주사를 쓰는 경우 주사 시기와 주사 종류를 꼭 기억할 것. 고혈당이나 저혈당으로 병원에 실려오는 환자들 중에 간혹 주사 종류를 착각하여 잘못 맞고 실려오는 경우가 있다고 한다. 펜주사기의 색깔, 라벨의 글자 색 같은 것으로 구분할 수 있다. 특히 초속효성 맞을 때인데 잘못하여 지속형을 맞는 경우 인슐린이 제대로 듣지 않아 치명적인 고혈당 위험이 있다.
6. 같이 보기
(원문)
세계의 위대한 혁신가들, 스완슨과 보이어
처음 만난 날 맥주 바에서 회사 설립 결정
미국의 지넨텍社는 설립할 당시만 하더라도 작은 벤처에 지나지 않았다. 그러나 설립한지 30년 만에 4백억 달러의 매출기업으로 성장했다. 성장의 비결은 기술력이다. 그 기술력이 DNA를 통해 처음으로 약품생산을 가능하게 만든 것이다.
1976년 새해가 시작되는 1월 어느 금요일 오후. 샌프란시스코에 있는 맥주 바에서 한 벤처기업 투자가와 명문대학의 생체물리학 교수가 서로 만나 맥주에 젖어가며 기업체 설립을 놓고 열띤 이야기를 주고 받고 있었다.
당시 29세에 불과했지만 야심가였던 로버트 스완슨(Robert Swanson)이 바로 그 날 캘리포니아 대학(University of California)에서 생화학과 생체물리학을 가르치고 있는 허버트 보이어(Herbert Boyer) 박사를 만나기 위해 샌프란시스코를 찾았다. 유전자를 약품생산에 이용해 보려던 로버트 스완슨이 보이어 박사를 ‘찜’한 것.
보이어 박사와 약속된 시간은 10분. 그러나 10분은 4시간으로 이어졌고 서로 마음이 통한 두 사람은 보이어 박사가 즐겨 찾는 시내에 있는 처칠스(Churchill’s)라는 맥주 바로 향했다. 맥주에 젖은 두 사람은 그날 바로 회사설립을 결정해 버렸다. 그 회사는 그들이 처음 만나 맥주를 함께 한지 3개월 만에 탄생했다.
벤처업체로 출발해 연간 4백억 달러의 매출을 올리고 있는 지넨텍(Genentech)의 역사는 이처럼 기업가 기질이 풍부한 로버트 스완슨과 청바지와 티셔츠를 즐겨 입는 보이어 교수와의 만남에서 비롯되었다.
유전자를 이용해 처음으로 의약품을 제조
1970년대 초반 많은 과학자들은 잡지와 같은 매체들을 통해 DNA 재조합 기술을 이용해 약품을 만들어 낼 수 있다는 가능성을 내비쳤다. 신선한 충격이었다. 그리고 많은 과학자들이 이를 상품화 하기 위한 노력에 심혈을 기울이고 있었다.
지넨텍이 설립된 지 불과 몇 년 만에 보이어 박사는 DNA를 잘라내어 다른 조직에서 추출한 DNA의 조각(fragments)들과 결합하는 기술을 완벽하게 시도하는데 성공했다. 서광이 비치기 시작했다.
곧이어 스탠포드 대학의 스탠리 코헨(Stanley Cohen) 박사도 가세하자, 보이어 박사는 다시 재결합된 DNA의 조각(segments)들을 인간의 몸 속에 있는 대장균(E-coli)에 주입하는 방법을 처음으로 발견해 내는데 성공했다. 이렇게 재조합된 세균들은 새로운 DNA에 의한 코드에 따라 의약품이 되는 단백질을 생성하게 된다.
1982년 지넨텍은 마케팅 파트너이자 미국 최대 제약회사인 일라이 릴리(Eli Lilly&Co.)社와 함께 미식품의약국(FDA)으로부터 처음으로 유전자에 의한 의약품인 휴먼 인슐린(human insuline) 개발 승인을 받았다. 의약계에서는 가히 혁명적인 일이었다.
그 이후 미국은 많은 생명공학 기업체들이 설립됐고, 많은 발전을 이룩해왔다. 유전자를 이용해 악성빈혈을 비롯해 각종 암을 치료하는 신약들도 개발해 냈다. 그러나 이 분야의 개척자는 역시 지넨텍이다.
직업은 서로 달라도 두 사람 모두 과학도 출신
벤처기업 투자가인 스완슨과 과학자인 보이어 박사는 과학을 사랑하는 마음에서는 공통점이 많다. 만나자 마자 처칠스 맥주 바에서 서로 5백 달러씩 투자해 1천 달러로 사업을 시작하는데 의기투합한 이면에는 과학에 대한 열정이 있었기 때문이다.
펜실베니아주 데리에서 자란 허버트 보이어는 원래 육상선수였다. 그러나 그가 다니던 고등학교의 미식축구와 농구코치이자 과학선생이 그의 재능을 이미 알아 채고 그를 설득해 이 과학분야를 택하게 된 것.
빈센트 대학(St. Vincent College) 시절 보이어는 1953년 DNA는 이중 나선형이라며 유전자연구에 일대 혁명을 불러일으킨 제임스 왓슨(James Watson)과 프란시스 크릭(Francis Crick) 박사에게 완전히 매료돼 있었다. 그리고 그 아름다운 구조를 읽기 위해 학구열을 불태웠다.
한편, 스완슨 사장은 뉴욕 부르클린에서 태어났고, MIT에서 화학과 경영학을 공부했다. 그는 원래 벤처기업 투자가로 Citicorp Venture Capital社에 처음 입사한 이후 Kleiner & Perkins社로 옮기기도 했다. 이 회사는 나중에 지넨텍에 무려 10만 달러를 투자하기도 했다.
우정이 깊은 과학자와 비즈니스맨이 만든 걸작품
지넨텍은 한 과학자와 한 비즈니스맨이 만들어 낸 훌륭한 걸작품이다. 이 회사의 CEO인 스완슨 사장은 벌어들인 수익을 투자가들에게 주식매각으로 나누어 줬다. 보이어 박사는 지넨텍에 근무할만한 과학자들을 잘 물색해 냈다. 그는 진정한 과학자이기도 하다. 지넨텍의 비밀스런 기술이 공개될지도 모를 위험을 무릅쓰고 영재들에게 그 기술을 연구해 발표해 보라고 한 것도 보이어 박사다.
스완슨 사장은 52세를 일기로 지난 1999년 뇌종양으로 죽었다. 회장직에서 은퇴한지 3년 만의 일이다. 부사장이던 보이어 박사는 1991년 이미 퇴직, 현재 이사로 남아 있다. 지넨텍은 미국에서만 1천4백 개가 넘는 회사들에게 자본을 투자했고, 작년 2백 92억달러의 매출을 올렸다.
칠순이 넘은 보이어 박사는 스완슨이 찾아 왔을 때를 이렇게 술회한다. “그가 나의 사무실로 걸어 들어 왔을 때 그는 나의 인생을 바꿨다. 그리고 수백만의 환자와 가족의 인생까지도.” 스완슨과 보이어는 위대한 업적을 남긴 혁신가다. 그리고 진정한 우정이 무엇인지를 가르쳐 준 아름다운 친구들이기도 하다.
(원문)
1973년 허버트 보이어 교수의 제한효소를 이용한 재조합DNA 실험
The general procedure described here is potentially useful for insertion of specifi c sequences from prokaryotic or eukaryotic chromosomes or extrachromosomal DNA into independently replicating bacterial plasmid.
여기 소개한 과정은 원핵생물이나 진핵생물의 염색체 또는 다른 DNA의 특정한 서열을 독립적으로 복제하는 박테리아의 플라스미드에 끼워 넣는 데 유용할 것이다.

1982년 10월 미국 식품의약품안전청(FDA)은 재조합 DNA 기술로 만든 최초의 의약품 휴물린(Humulin)의 판매를 승인했다. 휴물린은 인(human)과 인슐린(insulin)의 합성어로 박테리아인 대장균이 만든 인간 인슐린이다. 올해는 생명공학(BT) 기술이 본격적으로 상업화 된 지 30주년이 되는 셈이다.
휴물린 개발의 역사는 10여 년을 거슬러 올라가는데 이 기간 동안 줄곧 관여해 온 과학자가 바로 미국 UC샌프란시스코의 허버트 보이어 교수다. 1973년 그의 연구팀과 미국 스탠퍼드대의 스탠리 코언 교수팀이 함께 개발한 재조합 DNA 기술이 그 긴 여정의 출발점이다.
● 유용한 제한효소 발견
1936년 미국의 작은 도시 데리에서 철도노동자의 아들로 태어난 보이어는 미식축구, 농구, 야구 등 각종 스포츠에 뛰어났지만 공부에는 게을렀던 개구쟁이 소년이었다. 그 제한효소를 이용한 재조합DNA 실험 오리지널 논문으로 배우는 생명과학 25 1973년 허버트 보이어 교수의 런데 과학교사이기도 했던 미식축구 선생님의 조언으로 점차 공부에도 취미를 갖게 된다. 결국 집안에서 최초로 대학(세인트빈센트대)에 가게 된 그는 생물학과 화학을 전공했다. 1958년 졸업한 보이어는 의학대학원에 들어가려고 했지만 학부 때 철학과목인 형이상학에서 D학점을 받은 탓에 불합격했다. 결국 그는 피츠버그대 대학원에 진학해 미생물학을 연구했다.
1963년 박사학위를 받은 보이어는 예일대에서 박사후과정을 하게 되는데 여기서 연구주제가 바로 제한효소였다. 1960년대 발견된 제한효소는 박테리아가 외부에서 들어온 바이러스의 DNA를 파괴해 확산을 ‘제한’하기 위해 만들어내는 효소다. 제한효소는 DNA의 특정 염기서열을 인식해 자르는 걸로 추정됐다. 따라서 보이어를 비롯한 연구자들은 제한효소를 이용해 DNA를 조작하는 방법을 모색하기 시작했다.
1966년 UC샌프란시스코 미생물학과에 자리를 잡은 보이어는 제한효소 연구를 계속해 마침내 1972년 훗날 EcoRI(이코알원이라고 발음한다)이라고 이름붙은 제한효소를 발견한다. 연구자들은 이 효소가 DNA 이중나선에서 ‘GAATTC’ 서열을 인식해 절단한다는 사실을 밝혀냈다. 흥미롭게도 이 효소는 G와 A 사이를 자르기 때문에 두 가닥에서 잘리는 위치가 서로 달라 결국 잘린 말단에 염기4개 길이의 단일 가닥이 달려있게 된다. 따라서 이렇게 잘린 부분은 4개의 상보적인 염기 사이의 수소결합으로 다시 서로 달라붙기 쉽다.

보이어 교수는 이해 여름 하와이에서 열린 한 학회에서 이 연구 결과를 발표했다. 객석에서 보이어 교수의 발표를 듣던 미국 스탠퍼드대 스탠리 코언 교수는 자신이 하는 연구에 제한효소를 이용하면 멋진 일이 일어날 것임을 직감했다. 그는 플라스미드라는 목걸이처럼 생긴 박테리아의 DNA를 연구하고 있었다. 플라스미드는 박테리아의 게놈과 별도로 존재하는데, 박테리아들은 서로 빨대같은 대롱으로 연결한 뒤 플라스미드를 주고받는다. 플라스미드에는 특정 항생제에 저항성이 있는 유전자가 들어있을 수 있어 박테리아 집단이 짧은 시간에 항생제 저항성을 갖게 되는 수단이 된다.
코언 교수는 원형인 플라스미드를 특정 제한효소로 자른 뒤 여기에 양 끝이 잘린 자리와 상보적인 DNA 조각(원하는 유전자를 포함한)을 붙여 다시 원형으로 만들어주면, 즉 재조합하면 그 유전자를 포함한 플라스미드를 만들 수 있을 것이라고 생각했다. 그 뒤 이 재조합 플라스미드를 박테리아에 넣어주면(이를 형질전환이라고 부른다) 박테리아 세포 안에서 플라스미드가 복제되면서 이 유전자도 복제될 것이다(이 과정을 클로닝(cloning)이라고 부른다).
<이미지 크게보기>
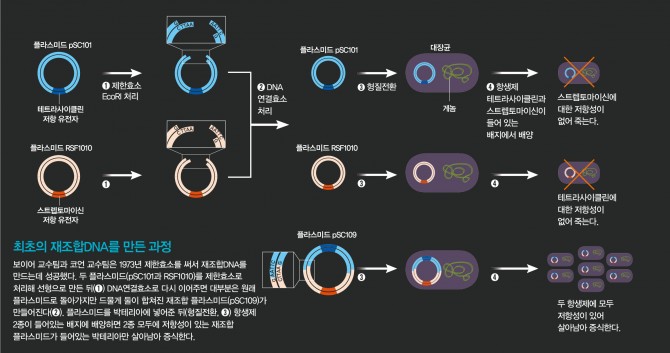
발표가 끝난 뒤 코언은 보이어 교수를 찾아가 자신의 아이디어를 얘기했고 보이어 교수는 코언 교수에게 자신들이 정제한 EcoRI을 조건없이 제공해 주겠다고 약속했다. 그러나 코언은 그럴 수 없다며 공동연구를 제안했다. 두 사람의 협력은 이렇게 시작됐고 이듬해 제한효소 처리를 한 두 플라스미드를 붙여 만든 재조합 플라스미드를 클로닝하는데 성공했다.
● 플라스미드 둘 합치는 데 성공

1973년 11월 ‘미국국립과학원회보(PNAS)’에 발표된 논문은 오늘날의 관점에서 보면 굉장히 단순한 내용이다. 그러나 당시에는 누구도 생각하지 못했던 결과였기 때문에 논문이 발표되자 생명과학계는 술렁거렸다. 이 논문은 비슷한 내용의 두 가지 실험을 다루고 있는데 좀 더 설명하기 쉬운 두 번째 실험을 소개한다.
연구자들은 테트라사이클린이라는 항생제에 대한 저항 유전자를 담고 있는 pSC101이라는 플라스미드와 스트렙토마이신이라는 항생제에 대한 저항 유전자를 갖고 있는 RSF1010이라는 플라스미드를 합쳐 새로운 플라스미드(pSC109로 명명)를 만들었다.
pSC101과 RSF1010은 각각 제한효소 EcoRI에 의해 잘리는 자리가 한 곳씩 있다. 따라서 이들 플라스미드에 EcoRI 처리를 하면 원형 플라스미드가 잘려 선형이 되고 용액 속에서 멋대로 움직이던 선형 분자의 끝 부분이 서로 만나 상보적인 염기가 수소결합을 이루며 일시적으로 붙어있게 된다. 이때 두 DNA 가닥을 서로 결합시켜주는 DNA 연결효소를 넣어주면 두 플라스미드가 서로 결합해 새로운 플라스미드를 만든다.
이렇게 재조합한 플라스미드를 대장균에 넣어준 뒤 배지에서 키우면 대장균이 증식하면서 재조합 플라스미드가 대량으로 복제된다. 그런데 서로 다른 두 선형 플라스미드가 만나 원형의 새로운 플라스미드를 만들 확률은 낮다. 제한효소 처리로 선형이 된 플라스미드의 양 끝이 다시 만나 DNA연결효소의 작용으로 다시 원형으로 되는 경우가 대부분이기 때문이다.
연구자들은 재조합 플라스미드가 들어간 대장균을 선별하기 위해 테트라사이클린과 스트렙토마이신이 같이 들어있는 배지에 대장균을 배양했다. 재조합 플라스미드만이 두 항생제 각각에 대한 저항 유전자를 갖고 있기 때문이다. 연구자들의 예상대로 이 배지에서 재조합 플라스미드를 갖고 있는 대장균만이 자라 선별됐다. 이는 재조합 플라스미드가 대장균 안에서 제대로 작동해 항생제 저항 유전자가 발현됐다는 뜻이기도 하다.
제한효소를 이용한 재조합DNA와 클로닝이 제대로 작동한다는 걸 확인한 연구자들은 다음 단계로 나갔다. 플라스미드에 고등생물체의 유전자를 넣는다는 계획이다. 당시만 해도 박테리아 같은 하등생물에 동물이나 식물의 유전자를 넣는다는 건 상상할 수 없었다. 그러나 1953년 왓슨과 크릭의 DNA 이중나선 발견 이후 모든 생물의 유전자는 DNA로 이뤄져 있다는 사실(예외로 일부 바이러스는 RNA로 이뤄져 있다)이 분명해지면서 동물의 유전자가 대장균에서 발현될 가능성도 배제할 수 없었다.

연구자들은 개구리의 DNA 조각을 얻어 플라스미드에 넣는 실험을 했고 어렵지 않게 성공했다. 동물의 DNA가 포함된 재조합 플라스미드가 대장균에서 아무 문제 없이 복제됐던 것이다. 연구 결과는 1974년 5월 ‘PNAS’에 실렸다. 이 논문이 시사하는 바는 너무나 명확했기 때문에 ‘뉴욕타임스’를 비롯한 언론들은 연구결과를 대서특필했다. 즉 개구리의 DNA가 들어가도 문제가 없다면 사람의 DNA(유전자)가 들어가도 문제가 없다는 뜻이다.
많은 사람들이 바로 주목한 건 사람의 인슐린 유전자다. 당뇨병 환자들을 대상으로 인슐린이 쓰이기 시작한 건 1920년대부터다. 인슐린이 혈당을 낮추는 호르몬이라는게 밝혀진 뒤 소나 돼지에서 추출한 인슐린이 사람에서도 작동한다는 게 알려지면서 동물에서 추출한 인슐린이 약품으로 쓰이기 시작한 것.
그러나 당뇨병 환자들이 점차 늘어나면서 인슐린 수급에 빨간불이 켜졌다. 인슐린은 소나 돼지를 도축할 때 췌장을 수거해 추출했기 때문에 생산량에 한계가 있었기 때문이다. 제약회사들은 화학적으로 인슐린을 합성하는 방법도 생각했으나 아미노산 51개로 이뤄진 복잡한 생체분자를 합성한다는 건 불가능한 일이었다. 이때 재조합DNA 기술이 나왔으니 주목을 받지 않을 수 없었던 것이다.
● 바이오벤처 제넨텍 만들어
1975년이 끝날 무렵 어느 날 보이어 교수는 한 당돌한 젊은이의 전화를 받았다. 재조합DNA 기술을 이용해 제품을 만드는 회사를 세우려고 하는데 한번 만나고 싶다는 것. 처음에는 바쁘다고 거절했지만 워낙 집요하게 매달리자 할 수 없이 10분의 시간을 내주기로 했다. 이듬해 1월 이들은 만났고 이야기는 10분을 훌쩍 뛰어넘어 맥주집으로 자리를 옮기며 3시간이 넘게 이어졌다.
보이어 교수의 혼을 빼 놓은 이 청년은 당시 29살인 실직자 밥 스완슨이다. 1947년 미국 뉴욕에서 태어난 스완슨은 10살 때인 1957년 구소련이 인공위성 스푸트니크호를 발사하는 걸 보고 과학과 기술에 흥미를 갖게 됐다. 고등학생 때까지 과학과 수학을 휩쓸던 그는 명문 MIT에 입학했지만 과학천재들의 집합소에서 처음 좌절을 맛본다. 화학을 전공한 그는 방학 때 화학회사에서 아르바이트를 했는데 이때 자신이 분자보다는 사람에 더 관심이 많다는 사실을 발견했다.
<이미지 크게보기>
결국 그는 화학과는 대충 다니고 경영학 공부에 전념했다. 졸업하고 은행에 취직한 스완슨은 벤처 투자 업무를 맡아 당시 떠오르던 산업인 전자공학, 컴퓨터 업체 투자에 관여했다. 그 뒤 벤처 캐피탈 업체로 옮겨 일하기도 했지만 결국은 쫓겨나 혼자 사업을 모색하던 중 보이어 교수와 연락이 닿은 것이다.
스완슨은 재조합DNA 분야를 이끌고 있는 보이어 교수의 이름을 앞세워 투자자를 찾았고 마침내 10만 달러(약 1억 1000만 원이지만 당시 물가를 고려하면 훨씬 큰 돈이다)를 유치하는 데 성공했다. 이 자금으로 이들은 ‘제넨텍(Genentech)’이란 이름의 회사를 만들었다. 보이어 교수가 즉석에서 만든 이름인 제넨텍은 유전공학 기술(genetic engineering technology)의 약어다. 제넨텍의 회장이 된 스완슨과 부회장이 된 보이어가 각각 2만5000주를 갖기로 했고 투자자(클라이너&퍼키니스)가 2만 주(한 주당 5달러로 계산)를 받았다.
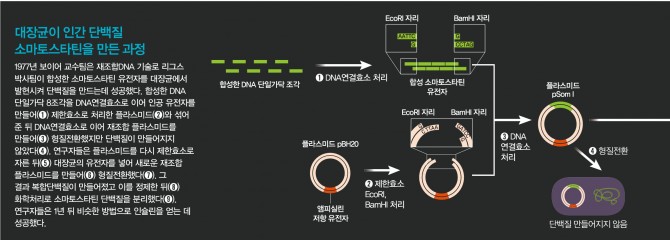
제넨텍의 첫 번째 과제는 당연히 인간 인슐린 유전자를 클로닝해 대장균이 인슐린을 대량으로 만들게 하는 일이었다. 그러기 위해서는 먼저 인간 인슐린 유전자를 확보해야 하는데 그때까지 누구도 해내지 못한 일이었다. 그런데 이들에게는 구세주가 있었다. 보이어 교수는 1975년 LA 근교에 있는 시티오브호프병원에서 재조합DNA 기술에 대한 강연을 했는데 이 자리에 참석한 아서 리그스박사의 관심을 끌었다.
리그스 박사팀은 화학적으로 DNA 조각을 합성해 인공 유전자를 만드는 방법을 연구하고 있었다. 만일 인공 인슐린 유전자를 만들어 플라스미드에 끼워넣어 클로닝하면 인슐린을 만들 수 있지 않을까. 보이어 교수와 리그스 박사는 공동연구를 하기로 했다. 이 소식을 들은 스완슨은 쾌재를 불렀고 열정적으로 추가 투자자를 모집했다.
그런데 막상 공동연구를 시작하자 리그스 박사팀의 연구자들이 한 발 뒤로 물러섰다. 인슐린 유전자를 화학적으로 합성하기에는 시간이 너무 걸리고 이 유전자가 박테리아 속에서 작동한다는 보장도 없기 때문에 먼저 작은 유전자로 시험을 해보자고 제안한 것. 그래서 이들이 선택한 게 소마토스타틴(somatostatin)이라는 아미노산 14개로 이뤄진 호르몬이다. 보이어 교수는 이들의 결정에 쉽게 동의했지만 시간이 급한 스완슨은 말도 안 되는 얘기라며 펄쩍 뛰었다. 이미 여러 연구팀에서 인슐린 연구에 뛰어든 마당에 시간낭비일 뿐이라는 것. 결국 보이어 교수가 스완슨을 달래야 했다.
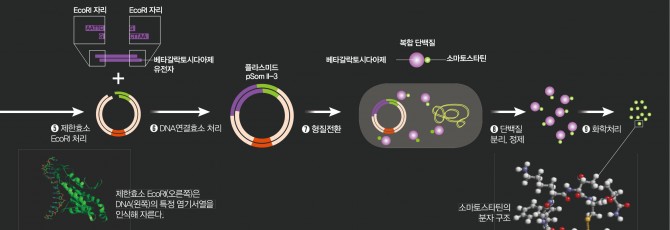
리그스 박사팀은 염기 10여 개 길이의 DNA 단일 가닥 8개를 합성한 뒤 이를 결합시켜 한쪽 끝은 EcoRI 자리를, 반대쪽 끝은 또 다른 제한효소인 BamHI(뱀에이치원이라고 발음한다) 자리를 지닌 인공 소마토스타틴 유전자를 만드는 데 성공했다. 이 유전자를 받은 보이어 교수팀은 즉각 재조합 플라스미드를 만들어 대장균에 집어넣었다. 그리고 대장균이 소마토스타틴을 만드는지 확인했다. 결과는 실망스럽게도 소마토스타틴이 만들어지지 않았다.
이 결과에 스완슨은 패닉상태가 됐지만 연구자들은 침착하게 그 원인을 고민했다. 이들은 대장균 내부에 소마토스타틴을 이물질로 인식해 파괴하는 단백질분해효소가 있다고 결론내렸다. 그렇다면 어떻게 이런 난관을 극복할 수 있을까. 연구자들은 베타갈락토시다아제라는 대장균의 유전자와 소마토스타틴의 유전자를 붙여서 발현시켜보자는 아이디어를 생각해냈다. 즉 작은 인간 단백질(소마토스타틴)이 커다란 대장균 단백질(베타갈락토시다아제)에 붙어 있다면 대장균의 단백질분해효소가 알아채지 못할 수도 있기 때문이다.
예상대로 만들어진 베타갈락토시다제-소마토스타틴 복합 단백질은 파괴되지 않고 세포 안에 축적됐고 이를 분리한 연구자들은 화학처리를 해 소마토스타틴을 떼어냈다. 마침내 박테리아가 사람의 단백질을 만들어내게 하는데 성공한 것이다. 이 연구 결과는 1977년 12월 9일자 ‘사이언스’에 실렸고 언론에 대서특필됐다. 이제 사람들은 박테리아가 인슐린도 만들 수 있다는 확신을 갖게 됐다. 소마토스타틴의 성공을 확인한 바로 다음날부터 리그스 박사팀은 인공 인슐린 유전자를 만드는 연구를 시작했다. 당시에는 인간 인슐린 유전자가 밝혀지지 않은 상태였기 때문에 연구자들은 인슐린의 아미노산 서열을 바탕으로 DNA 염기 서열을 정한 뒤 합성에 들어갔다. 인슐린은 아미노산 사슬 두 개가 합쳐져 만들어진 단백질이다. 따라서 DNA 조각도 2개를 만들어야 했다. 유독한 화학물질들이 가득한 실험실에서 밤낮을 가리지 않고 합성에 매달린 결과 6개월만에 인공 인슐린 유전자를 만드는 데 성공했다.
<이미지 크게보기>
그리고 막 구성된 제넨텍의 연구진이 두 유전자 조각을 받아 각각 플라스미드에 넣고 클로닝했다. 그리고 만들어진 단백질 두 조각을 합쳐 온전한 인슐린 단백질로 만드는 과정에 마침내 성공했다. 1978년 8월 21일의 일이다. 젊은 과학자들이 혼신의 노력을 바쳐 마침내 박테리아로부터 인간 인슐린을 얻어낸 것이다.
● 타임지 표지인물로 선정돼
이 소식을 들은 미국의 거대 제약회사 일라이 릴리(EliLilly)는 즉각 부회장 코르넬리우스 페팅어를 제넨텍으로 보내(불과 4일이 지난 8월 25일) 라이센스를 체결했다. 일라이 릴리는 선수금으로 50만 달러를 제공했고 제품화에 성공할 경우 제넨텍은 판매액의 6%를, 시트오브호프병원은 2%를 로열티로 받기로 했다. 그 뒤 제넨텍의 연구자들은 생산 규모를 키우는 공정을 개발했고 마침내 모든 난관을 극복하고 일라이 릴리에 기술이전을 완료했다. 그 뒤 일라이 릴리는 재조합DNA 기술로 만든 인간 인슐린에 대한 임상시험에 들어갔고 마침내 1982년 FDA의 승인을 얻게 된다.
1980년 10월 14일 제넨텍은 나스닥에 상장했는데 주당 35달러에 110만 주를 발행했다. 개장이 되자마다 주가는 80달러로 치솟았고 최고 89달러까지 오르다가 71달러에 첫날을 마감했다. 여러 차례 증자를 통해 각각 92만 5000주씩을 보유하고 있던 보이어와 스완슨은 하룻만에 6600만 달러(약 750억 원)의 갑부가 됐다. 생명과학자로서 자신의 연구결과를 바탕으로 이런 거부가 된 건 유례가 없는 일이었다. 보이어 교수는 유전공학의 선구자로 1981년 미국의 시사주간지 ‘타임’(3월 9일자)의 표지를 장식했다. 그럼에도 재조합DNA 기술을 개발한 보이어 교수와 코언 교수 모두 노벨상을 받지는 못했다. 현재의 생명과학이 있게 한 가장 중요한 기술을 개발한 이들이 노벨상을 받지 못했다는 건 이해하기 어려운 일이지만 아마도 과학을 상업화한 데 대한 과학계의 불쾌감이 원인으로 여겨진다.

1991년 55세의 나이에 일찌감치 은퇴한 보이어 교수는 그 뒤 전 세계 낚시의 명소를 돌아다니며 인생을 즐기고 있다. 또 1990년에는 예일대 의대에 무려 1000만 달러를 기부하기도 했다. 예일대는 이를 기념해 ‘보이어분자의학센터’라는 이름을 붙였다. 한편 스완슨 역시 1990년 회사를 물러났고 안타깝게도 1999년 52세의 한창 나이에 암으로 사망했다.
한편 제넨텍은 1980년대 후반 경영난을 겪으며 지분의 60%를 스위스의 제약회사 호프만-라 로슈에게 넘겼고, 2009년 호프만-라 로슈는 나머지 40%도 모두 사들여 자회사로 만들었다. 이때 주주들에게 지불한 금액이 470억 달러(약52조 원)에 이른다.
아래는 2021년 11월 22일 뉴스입니다~
(원문: 여기를 클릭하세요~)
인슐린, 당뇨병에서 인류를 구하다
인슐린이 발견되기 100년 전, 당뇨병은 불치의 병이었다. 생을 유지하는 방법은 식사를 엄격히 제한하는 것뿐이었다. 당뇨병 환자들은 하루 450킬로칼로리 미만으로만 음식을 섭취하는 일명 ‘굶주림 치료’를 받았고 이 때문에 기아 상태에서 겨우 목숨을 부지하거나, 감염이나 실명 같은 각종 합병증을 앓다 죽음에 이르렀다. 인슐린 발견은 이런 비극을 막아준 기적의 사건이었다.

인슐린 단백질의 모습. 인슐린은 포도당을 글리코겐으로 전환해 체내의 혈당을 떨어뜨리는 중요한 역할을 하는 호르몬이다. (출처: 위키미디어)
1709년 스위스 해부학자 요한 브루너는 췌장에 이상이 생기면 소변을 많이 보게 된다는 사실을 관찰했다. 췌장을 떼어 낸 개가 심한 갈증과 다뇨증을 보였던 것이다. 이후 당뇨병 환자를 부검하자 췌장이 심하게 망가져 있다는 사실이 여러 번 보고돼 췌장과 당뇨 사이에 모종의 관계가 있음을 최초로 확인했다.
1869년에는 당시 독일 의과대학생이었던 랑게르한스가 현미경으로 췌장을 관찰하던 도중에 소화액을 분비하는 선포 세포들(acinus cells)과 섬처럼 동떨어진 채 존재하는 세포 집단을 발견했다. 당시 랑게르한스는 그 세포 집단이 어떤 기능을 하는 지는 잘 몰랐지만 25년 뒤 프랑스의 생리학자 구스타브 라게스가 이 세포 집단이 탄수화물 대사를 조절하는 내분비 물질을 분비한다고 보고 이를 ‘랑게르한스섬’이라 명명했다.
췌장이 탄수화물 대사를 하지 못해 당뇨병이 발생한다는 사실을 실험으로 입증한 사람은 1889년 독일 생리학자 오스카 민코프스키와 요제프 폰 메링이다. 이들은 과거 요한 브루너처럼 개의 췌장을 제거하는 데 성공했는데, 그 개의 오줌에는 포도당과 케톤체가 포함돼 있었고 다뇨 증상을 보이다가 곧 죽고 말았다.
이들은 개의 증상이 당뇨병임을 알아차리고, 췌장을 잘라낸 것이 바로 당뇨병의 원인이라고 주장했다. 이후 이들이 실험했던 동물의 췌장을 잘라내는 기술이 널리 알려져 이를 이용해 췌장에서 분비되는 내분비 물질을 얻으려는 시도가 본격적으로 일어났다. 1916년경에는 영국의 생리학자 에드워드 샤피 셰퍼가 췌장의 랑게르한스섬에서 탄수화물 대사를 조절하는 특정 내분비물질이 분비된다고 가정하고 이 물질에 라틴어로 ‘섬’을 뜻하는 ‘insula‘에서 따온 ‘인슐린’이라는 이름을 붙였다.
인슐린이라는 내분비물질이 분비되는 장소를 정확히 특정하자 인슐린을 정제하려는 시도가 많이 이뤄졌다. 그중에서도 인슐린을 정제하는 데 성공하고 실제로 임상에 사용하는 데 기여한 인물은 캐나다 외과의사 프레더릭 밴팅과 찰스 베스트이다. 밴팅은 췌장으로 들어가는 영양분 공급을 막기 위해 췌관을 묶으면, 췌장이 수축돼 소화액 분비 기능을 잃지만 랑게르한스섬은 그대로 남아 있다는 점을 이용해 췌장을 얇게 잘라 분쇄하고 여과해 인슐린을 추출하는 연구를 했다. 이들은 처음에는 개를 이용했으나 당시 버려지는 부산물이었던 소의 췌장에서 인슐린을 마음껏 추출해 정제했다.

인슐린을 정제하고 최초로 환자에게 투여하는 데 성공한 찰스 베스트(왼쪽) 프레더릭 밴팅(오른쪽). (출처: 위키미디어)
◇인슐린은 계속 진보 중
인슐린 발견 후 당뇨병 환자의 생존율은 혁신적으로 향상됐고 그에 맞추어 인슐린 제제도 거듭 발전해 왔다. 초기 인슐린은 소의 췌장에서 추출한 속효성 인슐린으로, 보통 30분에서 1시간만에 빠르게 작용하지만 지속 시간은 8시간 이내로 길지 않아 하루에 세 번은 맞아야 했다.
이에 1936년에는 잠자는 동안에도 혈당을 조절할 수 있도록 프로타민이라는 저분자량의 단백질을 첨가한 장시간형 인슐린인 프로타민 인슐린이 개발됐다. 1959년에는 영국의 생화학자 플레더릭 생어가 소 인슐린의 아미노산 배열 순서를 완전히 규명함으로써 이를 토대로 1980년에는 유전자 재조합 기술을 활용해 인간 인슐린을 합성하는 데 성공했다.
환자의 편의와 효과적인 당뇨병 치료를 위해 인슐린에 대한 연구는 지금도 계속되고 있다. (출처: Shutterstock)
