
동아일보DB
평소 건강보조식품에 관심이 많은 필자는 특정 성분의 작용 메커니즘을 규명한 연구결과가 나오면 즐겨 읽곤 한다. 학술지 ‘네이처’ 11월 28일자에는 ‘코엔자임Q10’에 대한 논문 두 편과 해설이 실렸다.
코엔자임Q10(coenzyme Q10· 코큐텐)은 몸에 활력을 주고 항산화 효과가 있다고 해서 요즘 인기가 많은 성분이다. 코큐텐은 세포호흡으로 에너지 분자 ATP(아데노신3인산)를 만드는 세포소기관인 미토콘드리아의 전자전달계의 한 요소로 인체에서 만들어지는 분자다. 그런데 나이가 들수록 생성되는 양이 줄어들고 그래서인지 미토콘드리아가 ATP를 만드는 효율이 떨어진다.
이런 변화가 노화의 원인인지 결과인지는 단언할 수 없지만 노화와 관련된 것만은 분명하다. 따라서 건강보조식품으로 코큐텐을 먹어 부족해진 양을 보충해 미토콘드리아의 가동률을 높인다는 아이디어가 그럴듯해 보인다. 물론 실제 효과가 있는가는 별개의 문제이지만.
또 다른 세포사멸 과정
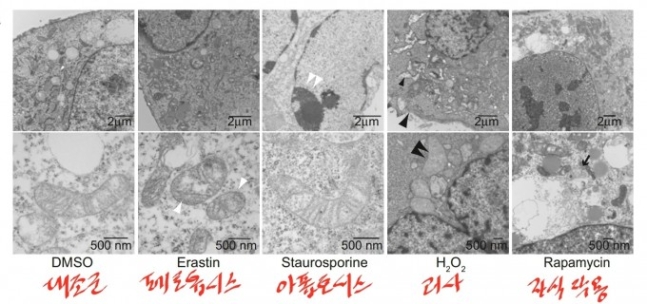
지난 2012년 페롭토시스라는 새로운 세포사멸 방식이 처음 보고됐다. 맨 왼쪽 대조군(정상 세포)과 비교했을 때 페롭토시스가 일어나는 세포는 미토콘드리아가 쭈그러졌고(흰 화살촉) 아폽토시스가 일어나는 세포는 염색질(chromatin)이 수축돼 있다(흰 쌍 화살촉). 괴사가 일어나는 세포는 세포질과 소기관이 부풀고 세포막이 터지고(검은 화살촉) 자식작용이 일어난 세포는 이중막 소체가 형성돼 있다(검은 화살표). ‘셀’ 제공
그런데 해설을 읽다 보니 이게 좀 다른 얘기다. 미토콘드리아가 아니라 세포막에 있는 코큐텐이 ‘페롭토시스’라는 세포사멸을 억제하는 메커니즘을 규명한 것이다. 세포사멸 하면 아폽토시스(apoptosis)라고 불리는 세포예정사(programmed cell death)나 동상이나 독성화학물질 등 외부손상, 감염에 따른 세포괴사(necrosis) 두 가지만 알고 있던 필자는 처음 보는 용어에 좀 당황했다.
게다가 2012년 학술지 ‘셀’에 발표한 논문에서 처음 쓰인 용어라니 나온 지도 꽤 됐다. 흥미롭게도 해설을 쓴 미국 컬럼비아대 브렌트 스톡웰 교수가 바로 이름을 지은 사람이다! 세포 내 철분이 많을 때 일어나는 세포사멸이라 페롭토시스(ferroptosis)라는 이름을 붙였다고 한다. 세포 내 철분 농도가 높아지면 세포막을 이루는 지질 분자가 쉽게 산화돼 과산화물로 바뀌면서 막이 부실해지고 결국 세포가 죽게 된다.
이번에 ‘네이처’에 발표된 논문 두 편은 세포막에 존재하는 코큐텐이 세포막의 지질 과산화물 생성을 억제해 페롭토시스가 일어나지 않게 하는 데 관여하는 효소를 규명했다는 내용이다(두 연구팀에서 동시에 밝혀 논문이 나란히 실렸다).
좀 더 자세히 설명하면 이렇다. 코큐텐의 또 다른 이름은 유비퀴논인데 FSP1이라는 효소가 이를 유비퀴놀(ubiquinol)이라는 분자로 환원시킨다. 그러면 유비퀴놀이 작용해 세포막의 지질 과산화물을 환원시키고 자신은 산화돼 다시 유비퀴논으로 돌아간다. 세포막에 유비퀴논이 부족하면 페롭토시스를 막기 어렵고 충분해도 FSP1이 없으면 소용이 없다는 말이다.
이번 발견의 의미는 페롭토시스를 막는 두 번째 메커니즘이 규명됐다는 것이다. 첫 번째 메커니즘은 2014년 보고됐는데, 역시 항산화제로 인기가 많은 건강보조식품인 글루타치온(glutathione)이 세포막 지질 과산화물을 없애 세포사멸을 막는다. 글루타치온은 GPX4라는 단백질과 짝을 이뤄 작용한다.
코큐텐이나 글루타치온 모두 뛰어난 항산화 작용을 통해 노화를 늦춘다는 개념이 들어있고 세포사멸이란 결국 노화의 한 측면이라고 했을 때 결국 이들 분자가 페롭토시스를 억제해 효과를 낸다는 말인가. 이제 필자의 관심은 코큐텐에서 페롭토시스로 옮겨졌다.
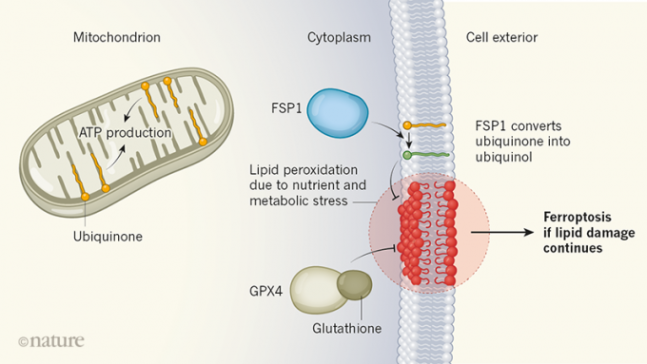
최근 페롭토시스를 억제하는 두 번째 메커니즘이 밝혀졌다. 즉 세포막에 있는 코큐텐(ubiquinone)의 환원형 분자(ubiquinol)가 지질 과산화물 라디칼을 환원시켜 안정한 분자로 돌려놓아 페롭토시스로 진행되는 걸 막는다(오른쪽 위). 코큐텐은 에너지 분자인 ATP를 만드는 미토콘드리아의 세포전달계를 이루는 구성원으로 알려져 있다(왼쪽). 한편 2014년 글루타치온이 지질 과산화물 라디칼을 환원시켜 페롭토시스를 억제하는 메커니즘이 처음 밝혀졌다(오른쪽 아래). ‘네이처’ 제공
암세포 페롭토시스 유도하는 항암제
뉴욕 컬럼비아대 생명과학과와 화학과의 교수인 브렌트 스톡웰은 라스(RAS)라고 부르는, 암을 유발하는 작은 단백질을 표적으로 삼는 항암제를 개발하고 있었다. 이렇게 찾아낸 분자 에라스틴(erastin)이 암세포를 죽이는 메커니즘을 밝히는 과정에서 아폽토시스나 괴사와는 다른 방식의 세포사멸을 관찰했다.
아폽토시스가 일어나기 전에 세포에 지질 과산화물을 비롯한 활성산소종(ROS)이 축적되는데 철분을 포획해 없애는 물질을 넣으면 ROS 생성이 억제되면서 세포사멸이 멈췄다. 세포 안에 철분이 있어야 일어나는 세포사멸이라는데 착안해 페롭토시스라는 이름을 붙여 2012년 발표한 것이다. 결국 에라스틴은 암세포의 페롭토시스를 유도해 효과를 내는 항암제다.
추가 실험을 통해 연구자들은 에라스틴이 아미노산 시스테인(cysteine)이 세포 안으로 들어오는 것을 막는다는 사실을 밝혀냈다. 시스테인과 또 다른 아미노산 글루탐산, 글라이신이 합쳐져 글루타치온이 만들어진다. 에라스틴 때문에 암세포 안으로 시스테인이 못 들어오니 글루타치온이 안 만들어지고 결국 세포막에 지질 과산화물이 쌓이는 걸 막지 못해 페롭토시스가 일어난 것이다.
그럼에도 몇몇 암에서는 에라스틴이 잘 안 들었고 따라서 세포막의 지질 과산화물 축적을 억제해 암세포의 페롭토시스를 막는 또 다른 메커니즘이 있을 것으로 추측됐는데 이번에 코큐텐과 FSP1 경로가 밝혀진 것이다. 따라서 FSP1 효소의 작용을 방해하는 약물을 만들면 항암제로 쓰일 수 있을 것이다.
자신이 발견하고 명명한 페롭토시스에 애착을 갖게 된 스톡웰 교수는(아폽토시스를 발견한 과학자들은 2002년 노벨생리의학상을 받았다!) 이게 암세포에서만 일어나는 현상이 아닐 거라는 ‘희망’을 갖고 시야를 넓혀 살펴봤다. 그 결과 아폽토시스처럼 페롭토시스도 보편적인 현상이고 특히 신경퇴행성질환과 밀접한 관련이 있다는 사실을 발견했다.
신경퇴행성질환은 신경세포(뉴런)가 과도하게 죽어 해당 부위의 신경조직이 제 기능을 하지 못해 일어나는 질병이다. 그런데 세포가 죽는 모습이 암세포의 페롭토시스와 비슷했던 것이다. 나이가 들수록 뇌의 철분 함량이 높아진다는 것도 스톡웰 교수의 입장에서는 반가운 사실이다.
그리고 도파민이 GPX4의 안정성을 높여주는 것으로 밝혀졌다. GPX4는 글루타치온과 짝을 이뤄 세포막 지질 과산화물 생성을 억제해 페롭토시스를 막는 단백질이다. 도파민 결핍으로 생기는 신경퇴행성질환이 파킨슨병이다.
아직 정확한 메커니즘은 밝혀지지 않았지만 페롭토시스는 분명히 조절된 세포사멸 방식이다. 세포막에 지질 과산화물이 어느 수준 이상 축적될 때 세포가 자살하는 스위치가 켜진다. 그럼에도 세포예정사처럼 정상 상태에서 기능이 밝혀지지는 않았다.
예를 들어 발생과정에서 태아의 손은 오리발처럼 손가락 사이에 막이 있는데 아폽토시스가 일어나 사라지며 다섯 손가락이 떨어진다. 이때 아폽토시스가 제대로 진행되지 않으면 막이 있는 채로 태어난다.
스톡웰 교수는 2017년 ‘셀’에 발표한 리뷰 논문에서 페롭토시스의 존재 이유 두 가지를 제안했다. 먼저 세포막 조성변화에 대응한 진화의 산물이다. 세포가 유동성을 지니고 다양한 환경에서 적응하기 위해 세포막에 불포화지방산의 비율이 높아지면서 불가피하게 산화에 취약해졌다. 그 결과 지질 과산화물이 축적되면 세포가 비정상적으로 기능하게 되고 결국 개체에 해가 된다. 따라서 어느 수준 이상이 돼 복구할 수 없다고 판단하면 자살 프로그램이 가동하게 진화했다는 것이다.
다음으로 암을 억제하는 수단으로 진화했다는 가설이다. 암은 생리 균형이 깨진 세포들로 이뤄져 있고 따라서 산화 스트레스에 약해 세포막에 지질 과산화물이 축적되기 쉽다. 따라서 이게 신호가 돼 세포가 죽는 시스템이 있다면 암세포에게는 아킬레스건이 될 것이다.
나이 들수록 암 위험성 준다?
리뷰논문을 읽다가 필자는 문득 신경퇴행성질환과 암이 페롭토시스의 관점에서 서로 반대되는 현상으로 볼 수 있는 게 아닌가 하는 생각이 떠올랐다. 페롭토시스가 어떤 기능을 지닌 조절된 세포사멸이라면 유전이나 환경 등 어떤 이유로 이게 좀 더 쉽게 일어나는 사람은 신경퇴행성질환에 걸릴 위험성이 높고 잘 안 일어나는 사람은 암에 걸릴 위험성이 높은 게 아닐까. 그렇다면 치매 환자는 암에 잘 안 걸린다는 말인가.
구글 창에 ‘relation between neurodegenerative disease and cancer’를 입력하고 엔터키를 쳤다. 놀랍게도 이런 관계는 이미 널리 알려진 사실인 듯 관련 논문들이 줄줄이 올라왔다. 이 가운데 지난해 학술지 ‘네이처 커뮤니케이션스’에 실린 논문이 눈길을 끌었다. 나이에 따른 유전자 발현 패턴 변화를 분석해 이런 관계를 확인했기 때문이다.
먼저 역학조사를 보면 신경퇴행성질환과 암은 대체로 역의 관계를 보인다. 예를 들어 알츠하이머병 환자는 암에 걸릴 위험성이 60%나 낮다. 한편 암에 걸린 적이 있는 사람은 알츠하이머병에 걸릴 위험성이 30% 낮다. 물론 그렇지 않다는 결과도 있고 암에 따라 편차가 크다는 연구도 있지만 전체적(통계적)으로 봤을 때 그렇다는 말이다.
논문에는 흥미로운 그래프가 두 개 나온다. (맨 아래) 먼저 연령대별 사망 원인을 보여주는 그래프로 맨 아래 암이 차지하는 비율이 변하는 패턴이 흥미롭다. 20세 전후 저점을 지나 늘어나다가 60세 무렵 정점에 도달하고(전체 사망의 40% 수준) 그 뒤 서서히 줄어 100세 무렵에는 10% 밑으로 떨어진다.
반면 심혈관계질환은 20대 이후 사망 원인에서 차지하는 비율이 꾸준히 늘어나 70대 이후에는 1위가 된다. 한편 60대부터는 신경퇴행성질환으로 사망하는 비율도 눈에 띄기 시작해 90대에는 암을 누르고 2위에 오른다.
노화가 진행될수록 몸의 정교함이 떨어져 암 발생 위험성이 높아진다고 알고 있던 필자로서는 뜻밖의 패턴이다. 그런데 생각해보면 나이가 들수록 사망 위험성 자체가 커지므로 상대적인 비율이 줄뿐이지 절대적인 발생 빈도는 여전히 늘어나는 것 아닐까.
아래 그래프는 연령대별 발병률을 보여주는데 놀랍게도 암은 75~84세가 정점이고 그 뒤로는 소폭이지만 감소세로 돌아선다. 반면 심혈관계질환은 꾸준히 늘어난다. 치매는 60대에야 무대에 등장하지만 그 뒤 급격히 늘어난다.
논문에는 페롭토시스가 나오지 않지만 나이가 들수록, 노화가 진행될수록 페롭토시스에 취약해지는 게 이런 패턴을 낳는 원인 아닐까. 생체반응에 정교함이 떨어져 암세포로 바뀔 가능성이 커지지만 암세포 자체도 부실해져 암 조직으로 발전하는 확률은 오히려 떨어진다는 말이다. 반면 심혈관계질환이나 신경퇴행성질환은 죽거나 부실해진 세포가 많아질수록 증상이 악화될 것이므로 노화가 진행될수록 발병 위험성은 커진다고 볼 수 있다.
이제 페롭토시스의 관점에서 건강보조식품을 생각해보자. 치매를 걱정하거나 초기 치매로 진단받은 사람에게 건강보조식품을 선물한다면 페롭토시스를 억제하는 코큐텐이나 시스테인, 글루타치온, 셀레늄(GPX4 단백질 생성에 필요하다), 비타민E(토코페롤. 세포막 지질 산화를 막는다) 같은 성분이 좋지 않을까. 반면 암환자는 굳이 의사가 권하지 않는다면 이런 성분을 찾아 먹을 것은 아니라는 생각이 든다. 한편 페롭토시스를 유도하는 철분이 함유된 영양제는 반대의 선택이 될 것이다.
물론 건강보조식품을 먹어도 별 효과가 없는 경우가 많아 지나치게 신경 쓸 일은 아닐 수도 있다. 어쨌든 방향이 그렇다는 말이다.

연령대별 사망 원인을 보여주는 그래프(위)와 발병률을 나타내는 그래프(아래)다. 암은 60대에 사망 원인에서 차지하는 비율이 가장 높고 그 뒤로는 급격히 떨어진다. 발병률도 75~84세가 피크다. 반면 심혈관계질환과 특히 신경퇴행성질환은 나이가 들수록 사망 원인에서 차지하는 비율도 높아지고 발병률도 높아진다. 이런 패턴의 변화는 페롭토시스로 설명할 수 있을지도 모른다. ‘네이처 커뮤니케이션스’ 제공
(원문: 여기를 클릭하세요~)