(원문)
Stem-cell tests must show success
Japan needs to demonstrate that a promising therapy for damaged hearts works as claimed.
Researchers in Japan, led by cardiac surgeon Yoshiki Sawa (second from right) at Osaka University, are pushing ahead with a stem-cell therapy for damaged hearts.Credit: Asahi Shimbun/Getty
As we report in a News story this week, Japan is set to push ahead with a promising treatment for heart disease that relies on stem cells. It could soon be made available under a fast-track approval system that the country put in place in 2014. Designed to speed access to regenerative therapies, the law allows prospective treatments to be marketed and used as long as they have been proved to be safe. Only a suggestion of efficacy is required — with more-convincing data supposed to be gathered retrospectively from patients who have been given the approved treatment.
The system has its critics — Nature among them (see Nature 528, 163–164; 2015). The latest move adds further concerns.
The therapy is the work of a physician who was also the first to take advantage of the new law with a related treatment: Osaka University cardiac surgeon Yoshiki Sawa. There is no suggestion that Sawa has not followed the rules, set out by the Pharmaceuticals and Medical Devices Agency. He has. The issue is whether those rules are adequate and appropriate and have the welfare of patients at their heart. They do not. Treatments of no proven efficacy are being sold to patients (who effectively subsidize the clinical trials to test them). They receive no refund if the therapy is subsequently found not to work. Patients also take risks: they undergo immunosuppression and the surgery itself.
The new study takes induced pluripotent stem cells (iPS cells) that have been banked and characterized to ensure they are safe, and converts them to heart-muscle cells. These are then spread into a thin sheet that is attached to the weakened heart muscle. It is only the second clinical application of iPS cells and is generating excitement around the world. The problem is that the earlier treatment from Sawa — which is ongoing under the fast-track system — has yet to produce convincing results.
In that treatment, approved in September 2015, patients received a sheet of muscle cells made from their own leg tissue, rather than from iPS cells. Called HeartSheet, the muscle sheet is attached to weakened heart muscle that has usually been damaged as a result of a heart attack or plaque build-up and is often the cause of heart failure. The scientists behind the treatment speculate that the muscle cells work by releasing growth factors, not by becoming supporting tissue themselves. Other researchers are sceptical.
Now there are two new treatments being investigated for the same condition, and it’s impossible to know yet whether either will work or which might be best for individual patients.
It makes sense that heart-muscle cells (used in the second study) might work better for the heart than leg-muscle cells (used in the first). Indeed, it was reported a decade ago that injecting muscle cells from the leg did not improve heart function (P. Menasché et al. Circulation 17,1189–1200; 2008).
Most physicians hoping to treat heart disease by way of regenerative medicine have moved on to other strategies, with many looking to heart-muscle cells. That doesn’t mean HeartSheet cannot work, but it does raise the question of whether patients who are given it will benefit.
Sawa himself has raised the issue. At a symposium last month touting the new iPS cell trial, he said “leg cells are not good, well, at least not enough”. And the Osaka University web page announcing the iPS cell trial says that HeartSheet was found to be ineffective for more serious cases. Sawa told Nature that the cells work in some cases, but that he expects the new iPS cell therapy to be more effective.
All this places a question mark over how the efficacy of HeartSheet can be proved as required. Half way through its scheduled 5-year plan, fewer than 10 patients — of the 60 required by the terms of its approval — have received the treatment. If the trial doesn’t make 60, the health ministry told Nature, there would either be an extension or the ministry would try to make a decision on the basis of the available data.
Some physicians have called for the HeartSheet tests to end and the data to be assessed before the new iPS cell study can begin. That might be an over-reaction, but pressure on the Japanese government is increasing. The government needs to move quickly to make sure that evaluation of the HeartSheet therapy is as rigorous as promised. As more treatments emerge, officials should make sure that — fast track or not — they have a valid claim to efficacy before being sold to patients.
A therapy for heart disease could be the first iPS-cell clinical breakthrough that Japan so ardently desires. The country shouldn’t sell short the promising technology or the patients who hope to benefit from it.
Nature 557, 611-612 (2018)
http://news.naver.com/main/read.nhn?mode=LSD&mid=sec&oid=009&aid=0004155766&sid1=001&lfrom=memo
회춘 등 만병통치약처럼 홍보하는 행위 단속 주문
과학적 근거 부족한데도 맹신하는 환자 피해 우려
배양·증식때 필요한 임상 없이 무차별 시술·치료 경종
업계 “줄기세포 치료 연구…완성형 아닌 현재 진행형”
“과학적 근거가 부족한 성체줄기세포 시술·치료 단속이 강화돼야 한다.”
영국의 저명한 과학학술지 ‘네이처’가 사설을 통해 미국 일부 병원에서 무분별하게 행해지는 성체줄기세포 치료·시술을 강하게 비판하고 나섰다. 과학적으로 효과가 입증되지 않은 상태인데도 여러 의료기관과 바이오업체들이 앞다퉈 성체줄기세포가 갖고 있는 효과를 과대포장하면서 그 피해를 고스란히 환자들이 입고 있다는 게 네이처 주장이다.
줄기세포를 마치 만병통치약처럼 홍보하면서 국내에서도 많은 병원과 바이오업체들이 성체줄기세포를 이용한 시술·치료 등을 하고 있는 가운데 국제적으로 파급력이 큰 네이처가 갑작스레 성체줄기세포 치료 효과에 대해 의문을 제기하면서 업계 파장이 만만치 않을 것이란 진단이다. 네이처는 “성체줄기세포 치료는 증거보다 공허한 기대에 이끌리는 경우가 많다”며 “일부 과학자와 의료기관, 바이오업체들은 기회에 편승하기 위해 자본에 줄을 섰고 제시할 수 있는 증거도 없이 성체줄기세포가 회춘에 도움이 된다고 홍보하고 있다”고 비판했다.
또 네이처는 “많은 기업이 느슨한 규제를 이용하는 한편 말기 질환자들의 절박한 마음을 악용해 이득을 얻으려 시도하고 있다”고 꼬집었다. 그러면서 네이처는 “성체줄기세포를 이용한 치료·시술이 갖고 있는 효과를 입증하는 실험은 소홀히 했다”며 “미국 규제 기관이 환자 보호를 위해 입증되지 않은 줄기세포 시술이나 치료를 하는 기관을 단속하는 데 속도를 내야 한다”고 주문했다.
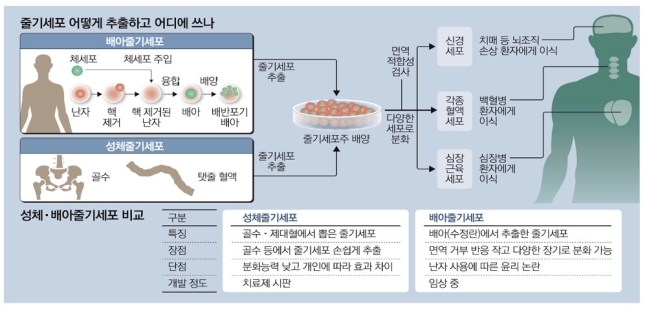
실제로 2015년 미국 한 바이오업체가 성체줄기세포를 이용해 노인황반변성을 치료하던 중 환자 3명이 실명하는 일이 발생했다. 현재 US스템셀로 이름을 바꾼 이 업체는 “성체줄기세포로 노인황반변성 치료가 가능하다”고 홍보해왔다. 하지만 US스템셀 사례에서 볼 수 있듯이 성체줄기세포를 이용한 치료는 아직 효과가 불확실하다는 게 비판론자들의 지적이다. 성체줄기세포는 성인 골수나 지방조직에서 추출한 미분화세포로 쉽게 얻을 수 있다. 다양한 세포로 분화하는 능력이 제한돼 개인마다 효과에서 큰 차이가 나기 때문에 아직 효과가 입증된 성체줄기세포 치료제는 나오지 않고 있다.
반면 네이처는 최근 노인황반변성 임상에서 뚜렷한 효과를 내고 있는 배아줄기세포 관련 연구를 언급하면서 성체줄기세포 역시 같은 길을 걸어야 한다고 주문했다. 네이처는 “20년 전 발견된 배아줄기세포는 난자에서 줄기세포를 추출해야 하는 윤리적 문제가 존재하지만 그만큼 철저한 검토를 거치면서 꾸준히 앞으로 나아가고 있다”며 “배아줄기세포 치료가 엄격한 연구를 통해 현재 임상에 진입했거나 임상을 앞두고 있다”고 설명했다. 국내 전문가들은 네이처 주장에 대해 시술과 치료에 대한 명확한 구분이 필요하다고 강조했다. 환자 몸에서 빼낸 줄기세포는 소량이라 하더라도 수천 배로 증식시켜야 치료 효과가 생긴다. 배양 과정에서 오염되거나 예상하지 못한 부작용이 나타날 수 있는 만큼 한국 미국 등 대다수 국가에서는 환자 몸에서 추출한 세포를 배양할 경우 ‘임상시험’이라는 까다로운 절차를 거치도록 했다. 임상을 거친 경우 이를 ‘치료제’나 ‘치료법’으로 환자에게 적용할 수 있다.
반면 성체줄기세포를 추출한 뒤 배양·증식 과정 없이 사람의 얼굴, 가슴 등에 넣는 것은 ‘시술’이라고 한다. 안전성 검사를 받을 필요가 없어 의사 재량에 따라 진행된다. 효과 또한 장담할 수 없다. 과거 규제가 느슨했던 일본에서 임상을 거치지 않고도 줄기세포를 배양한 뒤 환자에게 주입하는 게 가능했다. 일부 고위층 인사들이 수천만 원을 내고 일본으로 건너가 줄기세포 주사를 맞을 수 있는 것은 이처럼 규제가 허술하기 때문이다.
하지만 일본에서도 무분별한 줄기세포 시술로 사망하는 사람들이 발생하면서 ‘재생의료 등의 안전성 확보 등에 관한 법률’에 따라 관련 시술을 할 때 정부에 신고하도록 하고 있다. 김장환 한국생명공학연구원 줄기세포연구센터장은 “일본이 규제 법안을 만들었고 미국도 지난해 말 관련 규제를 강화해 무분별하게 이뤄지고 있는 성체줄기세포 시술에 대해 선을 긋고 있다”고 말했다. 김 센터장은 “지방에서 분리한 줄기세포를 여러 곳에 넣었을 때 어떤 일이 발생할지 알 수 없어 위험하다고 본다”며 “국내 병원에서 진행하는 줄기세포 시술은 모두 성체줄기세포를 이용한 만큼 확실한 과학적 기반 위에서 이뤄져야 한다”고 강조했다. 오일환 가톨릭대 의대 교수도 “새로운 산업을 키우는 차원에서 줄기세포 연구를 억누르면 안 되지만 모든 시술과 치료는 명확한 근거를 토대로 진행돼야 한다”며 “현재 이뤄지고 있는 줄기세포 시술을 마치 회춘이 가능하다거나 모든 병을 고칠 수 있다고 받아들여서는 절대 안 된다”고 경고했다. 국내에서 성체줄기세포를 연구하는 바이오업체들은 “엄격한 임상을 통해 치료제를 개발하고 있다”고 강조한다. 성체줄기세포 바이오업체인 파미셀 관계자는 “성체줄기세포를 이용한 치료는 엄격한 임상과 확실한 근거 위에서 진행돼야 한다는 데 동의한다”고 말했다.
또 다른 줄기세포 업체 관계자도 “일부 업체가 무분별한 시술을 마치 치료법으로 소개해 소비자를 현혹시키는 일이 발생하기도 한다”며 “네이처가 지적하는 것처럼 성체줄기세포 연구는 아직 완성형이 아닌 현재 진행형임을 소비자들도 명심해야 한다”고 말했다.
