The system allows researchers more control over DNA changes, potentially opening up conditions that have challenged gene-editors.
A new gene-editing tool called prime editing allows for greater precision and control over DNA edits compared to the popular CRISPR-Cas9 system (pictured).Credit: Juan Gaertner/SPL
For all the ease with which the wildly popular CRISPR–Cas9 gene-editing tool alters genomes, it’s still somewhat clunky and prone to errors and unintended effects. Now, a recently developed alternative offers greater control over genome edits — an advance that could be particularly important for developing gene therapies.
The alternative method, called prime editing, improves the chances that researchers will end up with only the edits they want, instead of a mix of changes that they can’t predict. The tool, described in a study published on 21 October in Nature1, also reduces the ‘off-target’ effects that are a key challenge for some applications of the standard CRISPR–Cas9 system. That could make prime-editing-based gene therapies safer for use in people.
The tool also seems capable of making a wider variety of edits, which might one day allow it to be used to treat the many genetic diseases that have so far stymied gene-editors. David Liu, a chemical biologist at the Broad Institute of MIT and Harvard in Cambridge, Massachusetts and lead study author, estimates that prime editing might help researchers tackle nearly 90% of the more than 75,000 disease-associated DNA variants listed in ClinVar, a public database developed by the US National Institutes of Health.
The specificity of the changes that this latest tool is capable of could also make it easier for researchers to develop models of disease in the laboratory, or to study the function of specific genes, says Liu.
“It’s early days, but the initial results look fantastic,” says Brittany Adamson, who studies DNA repair and gene editing at Princeton University in New Jersey. “You’re going to see a lot of people using it.”
Prime editing may not be able to make the very big DNA insertions or deletions that CRISPR–Cas9 is capable of — so it’s unlikely to completely replace the well-established editing tool, says molecular biologist Erik Sontheimer at the University of Massachusetts Medical School in Worcester. That’s because for prime editing, the change that a researcher wants to make is encoded on a strand of RNA. The longer that strand gets, the more likely it is to be damaged by enzymes in the cell.
“Different flavours of genome-editing platforms are still going to be needed for different types of edits,” says Sontheimer.
But prime editing appears to be more precise and versatile than other CRISPR alternatives developed thus far. Those include modified versions of CRISPR–Cas9 that enable researchers to swap out one DNA letter for another, and older tools such as zinc-finger nucleases, which are difficult to tailor to each desired edit.
Freedom through control
CRISPR–Cas9 and prime editing both work by cutting DNA at a specific point in the genome. CRISPR–Cas9 breaks both strands of the DNA double helix and then relies on the cell’s own repair system to patch the damage and make the edits. But that repair system is unreliable and can insert or delete DNA letters at the points where the genome was cut. This can lead to an uncontrollable mixture of edits that vary between cells.
In addition, even when researchers include a template to guide how the genome is edited, the DNA repair system in most cells is far more likely to make those small, random insertions or deletions than to add a specific DNA sequence to the genome. That makes it difficult — and in some cases, nearly impossible — for researchers to use CRISPR–Cas9 to overwrite one piece of DNA with a sequence of their choosing.
Prime editing bypasses these problems (see ‘Precision editor’). Although it also uses Cas9 to recognize specific DNA sequences — just like CRISPR–Cas9 does — the Cas9 enzyme in the prime editing tool is modified to nick only one DNA strand. Then, a second enzyme called reverse transcriptase and guided by a strand of RNA, makes the edits at the site of the cut.
The prime editing enzymes don’t have to break both strands of DNA to make changes, freeing researchers from relying on the cell’s DNA repair system — which they can’t control — to make the edits that they want. This means that prime editing could enable the development of treatments for genetic diseases caused by mutations that aren’t easily addressed by existing gene-editing tools.
A multipurpose tool
Previously, researchers, including Liu, thought that they would need to develop gene-editing tools specific to each category of change they wanted to make in a genome: insertions, deletions or DNA letter substitutions. And the options were limited when it came to making precise substitutions.
An older technique, called base editing, which is comparable in precision to prime editing, chemically converts one DNA letter directly into another — something CRISPR–Cas9 can’t do — such as converting a T to an A or a G to a C, without breaking both DNA strands2. Developed by Liu, base-editing could be useful for correcting some genetic diseases caused by single-letter mutations, including the most common form of sickle-cell anaemia.
But base-editing can’t help with genetic disorders caused by multi-letter mutations such as Tay–Sachs disease, a usually fatal illness typically caused by the insertion of four DNA letters into the HEXA gene.
So Liu and his colleagues set out to create a precise gene-editing tool that gave researchers the flexibility and control to make multiple types of edits without having to create bespoke systems. In 2018, the team hit on prime editing: a combination of enzymes, including a modified Cas9 enzyme, that could change individual DNA letters, delete letters, or insert a series of letters into a genome, with minimal damage to DNA strands.
“It’s fantastic,” says Sontheimer. “The breadth of the mutations that can be introduced is one of the biggest advances. That’s huge.”
But Liu’s team and others will now need to carefully evaluate how well the system works in a variety of cells and organisms. “This first study is just the beginning — rather than the end — of a long-standing aspiration in the life sciences to be able to make any DNA change at any position in an organism,” says Liu.
Nature 574, 464-465 (2019)
(원문: 여기를 클릭하세요~)
4세대 유전자기술 `프라임 에디터`…유전병 90% 치료 길 열어
하버드·MIT연구팀 네이처 발표
컴퓨터로 문서 작성하듯
DNA 유전코드 자유편집
크리스퍼 가위보다 정확성↑
7만5천종 질환 치료에 새 길
동식물 품종 개량에도 활용
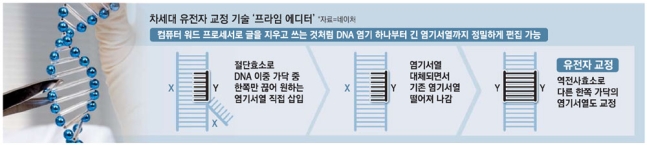
컴퓨터 워드프로세서로 글자를 쓰고 지우는 것처럼 인체 DNA 유전코드를 하나하나 자유자재로 편집할 수 있는 차세대 유전자 교정 기술이 탄생했다. 이 기술을 적용하면 현존하는 유전질환 중 90%를 치료할 수 있을 것으로 기대된다.
유전자 교정 분야의 세계적 석학인 데이비드 류 미국 하버드·매사추세츠공대(MIT) 브로드연구소 교수와 연구진은 21일(현지시간) DNA에서 유전코드를 구성하는 특정 염기나 염기서열을 떼었다 붙였다 하면서 정밀하게 교정할 수 있는 ‘프라임 에디터’를 개발했다고 국제학술지 네이처에 밝혔다.
이 유전자 교정 기술은 DNA에서 원하는 유전자만 선택적으로 잘라내 유전자를 교정하는 기존 3세대 ‘크리스퍼(CRISPR-Cas9)’ 유전자 가위보다 정확하고 정밀하게 유전자를 교정할 수 있다. 따라서 앞으로 각종 난치성 유전질환 치료 가능성을 획기적으로 높이는 것은 물론, 동식물 품종 개량에도 널리 활용될 수 있다.
류 교수는 이날 네이처 주관 언론 브리핑에서 “과거 ‘크리스퍼’가 유전자 가위이고 ‘염기 교정’이 연필이었다면 ‘프라임 에디터’는 유전자 워드프로세서”라며 “적용 범위가 이전보다 넓어 현존 7만5000종에 달하는 유전질환 중 90%를 치료할 수 있을 것”이라고 말했다. 류 교수의 설명에 따르면 프라임 에디터를 활용했을 때 컴퓨터로 문서를 편집하듯 아데닌(A)과 티민(T), 시토신(C), 구아닌(G) 등 염기서열로 만들어진 DNA 유전코드를 자유자재로 편집할 수 있다. 대다수 유전질환이 단 몇 개 염기가 바뀌면서 발병한다는 점에 비춰 볼 때 유전코드 교정을 통해 유전질환 치료 가능성을 대폭 높일 수 있다.
유전코드를 교정해 고칠 수 있게 된 대표적인 질환이 겸상적혈구빈혈증이다. 겸상적혈구빈혈증은 특정 A 염기 하나가 T로 바뀌었을 때 발병한다. 치명적인 신경계 질환인 테이삭스병도 마찬가지다. 테이삭스병은 단 4개 염기가 DNA에 잘못 삽입될 때 나타나는 질환이다.
프라임 에디터의 또 다른 장점은 기존 크리스퍼 유전자 가위를 사용할 때 나타났던 ‘표적 이탈’ 현상을 획기적으로 줄일 수 있다는 것이다.
크리스퍼는 DNA에서 특정 유전자를 잘라낸 뒤 작동하는 세포의 자연적인 DNA 복구 시스템을 활용해 유전체를 교정한다. 하지만 이런 세포의 DNA 복구 과정은 인간이 제어할 수 없기 때문에 그 과정에서 의도치 않은 염기서열이 삽입되거나 없어지는 문제가 발생했다. 이는 예상치 못한 부작용으로 이어질 수 있어 크리스퍼 임상 적용에 큰 걸림돌이 됐다.
하지만 프라임 에디터는 워드프로세서에서 글자를 쓰고 지울 수 있는 것처럼 DNA 염기서열을 직접 갈아 끼워 넣는 방식으로 교정하기 때문에 정확성이 훨씬 높다는 게 연구진의 설명이다. 프라임 에디터는 표적 부위의 DNA를 이루는 이중 가닥 중 한쪽 가닥만 끊어 여기에 원하는 염기서열을 삽입한다. 기존에 이 부위에 있던 염기서열이 떨어져 나가면 프라임 에디터의 ‘역전사 효소'(염기가 쌍을 이루도록 DNA 가닥을 만드는 효소)가 삽입된 염기서열의 유전정보를 토대로 다른 한쪽의 DNA 가닥까지 교정한다. DNA 이중 가닥을 모두 자르지 않기 때문에 세포의 DNA 복구 시스템을 동원할 필요가 없다. 다만 류 교수는 “프라임 에디터의 분자 크기는 상대적으로 크기 때문에 바이러스 등 세포까지 잘 전달할 수 있는 시스템이 필요하다”며 “향후 살아 있는 동물에게 프라임 에디터를 주입해 유전자를 교정하는 실험도 진행할 것”이라고 설명했다.
류 교수는 2016년 세계 최초로 DNA에서 특정 염기 하나만 정확하게 바꿀 수 있는 ‘염기 교정’ 기술을 개발해 학계를 놀라게 한 바 있다.
김진수 기초과학연구원(IBS) 유전체교정연구단장은 “적용 범위가 제한적이었던 염기 교정의 한계를 극복한 프라임 에디터는 유전체 교정 분야에 한 획을 그을 만한 대단한 성과”라면서도 “유전자 제거 등에는 아직까지 크리스퍼가 좀 더 유용한 측면이 있기 때문에 프라임 에디터가 크리스퍼를 완전히 대체하기보다는 상호 보완적인 두 기술이 함께 쓰일 것으로 보인다”고 평가했다.
네이처는 이번 연구 성과의 독창성과 사회적 파급력 등을 고려해 이례적으로 연구진의 ‘프리뷰 논문’을 공개했다. 정식 논문은 오는 28일자 네이처 온라인판에 게재될 예정이다.
(원문: 여기를 클릭하세요~)
아래는 2022년 7월 1일 뉴스입니다~
(원문: 여기를 클릭하세요~)
크리스퍼 유전자가위 빛 본지 10년…세상에 없었던 치료법이 나온다
크리스퍼 유전자가위 기술은 최근 생명과학에서 가장 혁신적인 기술로 꼽히고 있다. 유전정보를 담고 있는 DNA에서 특정 부위를 잘라내 편집하고 교정하는 과정의 모식도. 위키미디어 제공.
미국의 생명공학기업 카리부 바이오사이언스가 ‘크리스퍼(CRISPR) 유전자가위’로 면역세포의 유전자를 교정해 암세포를 효과적으로 공격하는 방법을 찾는 연구를 진행하고 있다. 크리스퍼 유전자 가위 기술은 생명정보를 담은 DNA 염기를 잘랐다 붙이는 유전자 편집 기술 중 3세대 기술로 분류된다. 회사가 개발하는 암 치료 연구는 암 극복을 위한 획기적이고 새로운 도전으로 평가된다. 이 회사는 21세기 최고의 생명공학 기술로 평가되는 크리스퍼 유전자 가위를 개발해 2020년 노벨 화학상을 수상한 제니퍼 다우드나 미국 버클리 캘리포니아대(UC버클리) 교수가 이끌고 있다.
다우드나 교수와 노벨상을 공동 수상한 프랑스 국적 에마뉘엘 샤르팡티에 독일 막스플랑크연구소 교수가 스위스에 설립한 생명공학기업 크리스퍼 쎄라퓨틱스도 혈중 산소량이 부족해 생기는 유전질환인 겸상 적혈구 빈혈 환자 31명을 대상으로 크리스퍼를 활용한 치료법의 임상시험을 진행한 결과 고무적인 성과를 얻었다고 지난 12일 밝혔다. 연구실의 성과로만 남아있던 크리스퍼 유전자 가위가 실제 임상에서 잇따라 성과를 내면서 인간의 난치병 극복에 한걸음더 다가섰다는 평가가 나온다.
● 지금까지 없었던 치료법이 나온다
크리스퍼 유전자가위는 크리스퍼로 불리는 리보핵산(RNA)과 효소 단백질을 이용해 동식물의 유전정보가 담긴 DNA에서 특정 부위를 정확히 찾아 잘라내는 기술이다. 10년 전인 2012년 6월 28일 다우드나 교수가 주도한 국제연구팀이 국제학술지 ‘사이언스’를 통해 박테리아를 대상으로 한 실험결과를 처음 세상에 내놓은 이후 10년 만에 크리스퍼가 나오기 전에는 생각조차 할 수 없었던 질병 치료법이 두각을 드러내며 잠재력을 폭발시키고 있다.
영국에서는 크리스퍼를 활용한 유전자 교정 작물 승인이 ‘초읽기’에 들어가 식량 혁명을 예고하고 있다. 고생물을 연구하는 진화생물학자들도 크리스퍼로 네안데르탈인을 연구할 정도다. 한편에선 인간 배아에 대한 유전자 교정 시도 등 생명윤리 논란에 혜안을 제시해야 한다는 목소리도 나온다.
지난달 12일 크리스퍼 쎄라퓨틱스가 공개한 임상시험 결과는 미국 보스턴 소재 생명공학기업 버텍스와 공동으로 진행했다. 빈혈을 일으키는 유전질환인 겸상 적혈구 빈혈과 베타 지중해 빈혈 환자 75명을 대상으로 크리스퍼 치료법을 활용한 임상시험 결과를 공개했다. 이들 유전질환은 산소를 운반하는 적혈구의 주요 단백질인 헤모글로빈이 손상돼 혈중 산소량 부족으로 빈혈을 호소하는 질환이다.
연구진은 태아일 때만 활성화되고 출생 후 몇 개월 내 기능을 멈추는 ‘태아 헤모글로빈’에 주목했다. 임상시험 지원 환자의 골수에서 미성숙한 혈액세포를 추출한 뒤 크리스퍼 기술을 이용해 태아 헤모글로빈 유전자 작동을 멈추는 스위치 역할을 하는 부위를 잘라냈다. 이렇게 유전자 교정된 혈액세포를 환자에 다시 주입해 손상되지 않은 헤모글로빈이 풍부한 적혈구를 생성할 수 있도록 했다.
임상 결과 베타 지중해 빈혈로 치료받는 44명의 환자 중 42명이 수혈이 필요하지 않을 정도로 호전됐고 31명의 겸상 적혈구 빈혈 환자 중 혈중 산소량 감소를 호소하는 환자가 없는 것으로 나타났다. 두 회사는 올해 안에 규제당국에 치료법 승인을 요청할 계획이다.
영국 소재 바이오벤처 인텔리아쎄라퓨틱스는 미국 생명공학 기업 리제네론과 협력해 손상된 간 단백질이 혈액에 쌓이면서 생기는 희귀 유전질환인 ‘아밀로이드증’을 크리스퍼를 이용해 치료하기 위한 임상시험을 진행중이다.
유전자 교정 작물에 대한 연구도 활발하다. 케이시 마틴 영국 존인스센터 교수 연구팀은 국제공동연구를 통해 크리스퍼 유전자가위 기술로 프로비타민D3가 함유된 토마토를 개발하고 지난 5월 국제학술지 ‘네이처 식물’에 발표했다. 영국 스타트업 이나리 애그리컬처는 크리스퍼를 이용해 물과 비료를 덜 사용하는 대두와 작물 품종을 개발하고 있다.
이와 관련 영국 정부는 지난 5월 크리스퍼를 이용한 유전자 교정 농작물을 유전자 변형 농작물(GMO) 규제 대상에서 제외하는 법안을 의회에 상정했다. 유전자 교정 농작물은 다른 종의 유전자를 삽입해 원하는 형질을 얻는 GMO와는 다른 기술이라는 판단이다. 통과할 경우 비타민D가 다량 함유된 유전자 교정 토마토가 식탁에 오를 전망이다.
● 특허 분쟁·생명윤리 논란도 관심
‘세기의 특허 전쟁’으로 불리는 특허 분쟁도 관심사다. 미국 매사추세츠공대(MIT)와 하버드대가 공동으로 설립한 브로드연구소가 다우드나 교수가 속한 UC버클리보다 유리한 판정이 잇따라 나오고 있는 가운데 내년 상반기로 예상되는 특허 항소심 결과에 관심이 모인다.
2018년 허젠쿠이 전 중국 남방과학기술대 교수가 크리스퍼를 인간 배아에 적용해 후천성면역결핍증(AIDS)을 유발하는 인체면역결핍바이러스(HIV)에 면역을 지닌 유전자 교정 아기를 태어나게 해 과학계를 놀라게 하면서 생명윤리 논란도 뜨겁다. 과학자들은 “결국 크리스퍼로 키를 크게 하거나 눈동자 색깔을 바꾸고 지능을 높이는 배아 교정이 허용될 수 있는지 전 사회가 고민해야 할 것”이라고 밝혔다.

