생명체 진화 화학적 설계 연구분야 연구자인 프란시스 아놀드, 조지 스미스, 그레고리 윈터가 2018년 노벨화학상을 수상했군요^^
(원문: 여기를 클릭하세요~)
‘Test-tube’ evolution wins Chemistry Nobel Prize
Frances Arnold, Gregory Winter and George Smith controlled evolution in the lab to produce greener technologies and new medicines.
Gregory Winter (left), Frances Arnold and George Smith share this year’s Nobel Prize in Chemistry.Credit: L–R: Aga Machaj; Caltech; Univ. Missouri-Columbia
Ways to speed up and control the evolution of proteins to produce greener technologies and new medicines have won three scientists the 2018 Nobel Prize in Chemistry.
Chemical engineer Frances Arnold, at the California Institute of Technology in Pasadena, is just the second woman to win the prize in the past 50 years. She was awarded half of the 9-million-Swedish-krona (US$1 million) pot. The remaining half was shared between Gregory Winter at the MRC Laboratory of Molecular Biology in Cambridge, UK, and George Smith at the University of Missouri in Columbia.
Arnold carried out pioneering work in the 1990s on ‘directed evolution’ of enzymes. She devised a method for inducing mutations in enzyme-producing bacteria and then screening and selecting the bacteria to speed up and direct enzyme evolution. These enzymes, proteins that catalyse chemical reactions, are now used in applications from making biofuels to synthesizing medical drugs.
“Biology has this one process that’s responsible for all this glorious complexity we see in nature,” she told Nature shortly after the prize announcement on 3 October. But although nature operates blindly, scientists know what chemical properties they want to get from an enzyme, and her techniques accelerate natural selection towards those goals. “It’s like breeding a racehorse.”
Antibody breakthrough
In 1985, Smith pioneered a method known as phage display. The technique uses a bacteriophage — a virus that infects bacteria — as a host that displays a protein on its outer coat, allowing researchers to find other molecules that interact with the protein. Winter developed and improved this technology, and invented ways to use it to evolve antibodies adapted for use as human therapeutics. Today, antibodies evolved using this method can neutralize toxins and counteract autoimmune diseases.
The first humanized antibody, called adalimumab (Humira), was discovered by Cambridge Antibody Technology — a company that Winter co-founded in 1989 — and was approved for treating rheumatoid arthritis in 2002. It is also used to treat psoriasis and inflammatory bowel diseases. In 2017, it was the world’s top-selling drug, generating revenues of $18.4 billion.
Scepticism abounded when the company was founded, says co-founder David Chiswell, and it struggled to find investors. “It was one of the earliest generations of European biotechs,” says Chiswell, who is now chief executive of Kymab, an antibody company also in Cambridge. “It was exciting times because we didn’t know what we were doing. And nobody in the world believed that antibodies were really good.”
Cold reception
Arnold also faced an uphill battle when she put forward the idea of evolving proteins in the lab, says Dane Wittrup, a protein engineer at the Massachusetts Institute of Technology in Cambridge. At the time, researchers thought that they would be able to sit down at a computer and rationally design proteins to carry out specific functions. “It was counter-cultural at the time,” he says. “But now, by and large, directed evolution is how the work is done.”
Nicholas Turner, an organic chemist at the University of Manchester, UK, agrees. “Pretty much every enzyme that is used for commercial-scale application will have been through some form of directed evolution,” he says.
Winter previously told Nature Biotechnology that he was lucky because the Laboratory of Molecular Biology had given him “carte blanche” to get on with his work without distinguishing between pure and applied science. “It would have been very difficult to have made my inventions on classic grant funding (it would have been seen as too applied) or on industry money (it would have been seen as too early, and anyway most companies weren’t interested in antibodies at the beginning),” he said.
When asked about the impact of Brexit on UK science during a press conference on 3 October, Winter expressed some optimism. “So long as it’s not made difficult for us or more difficult than it is in the moment, then I think it won’t be too much of a problem,” he said. But, he added, if it becomes difficult to bring in top-ranked researchers from the rest of Europe, the outlook could be grim. “We need to stress to the government that they could end up killing a lot of UK science,” he said.
Winter also said that his drive to push his research out of the laboratory and into the clinic came from an early encounter with a woman with cancer who had received an early, experimental version of one of his humanized antibodies against a cancer-related protein. When Winter warned her that the effects of the therapy might not last, she told him not to worry: she only needed to live for a few more months, so that she could help her dying husband. “I was so choked by that,” Winter says..
During the prize announcement, Claes Gustafsson, chair of the Nobel Committee for Chemistry 2018, noted the benefits of the researchers’ work for humanity: “Our laureates have applied principles of Darwin in the test tubes, and used this approach to develop new types of chemicals for the greatest benefit of humankind.”
Female laureates
Before Arnold, the last woman to win the Nobel Prize in Chemistry was Ada Yonath, a crystallographer at the Weizmann Institute of Science in Rehovot, Israel, who won in 2009 for mapping the structure of the ribosome, which generates proteins from the genetic code in cells. Before her, the most recent woman to win was crystallographer Dorothy Hodgkin, in 1964. Arnold is just the fifth female winner in the prize’s history. In 2016, she won the Millennium Technology Prize for her research.
Arnold was “stunned” when she received the call from Stockholm in the middle of the night. “It took me a minute to collect my wits.” She says that she realized early on how powerful her methods could be. “It was clear to me right away, but not yet to the rest of the world.”
And her favourite applications of directed evolution have yet to be realized. One of her dreams is to create an enzyme that can take carbon dioxide from the atmosphere and convert it to materials and fuels.
https://news.naver.com/main/read.nhn?mode=LSD&mid=sec&oid=025&aid=0002853903&sid1=001&lfrom=memo
지난해만 20조원 팔린 신약 휴미라 만든 기초 연구…2018 노벨 화학상 수상

올해 노벨 화학상은 박테리아의 진화를 화학적으로 가속하는 연구를 통해 신약과 바이오 연료 등을 개발하는 데 기여한 과학자들에게 돌아갔다.
스웨덴 왕립과학원 노벨위원회는 3일(현지시간) 프란시스 아놀드(62ㆍ여) 미국 캘리포니아공대(칼텍) 교수와 조지 스미스(79) 미주리대 명예교수, 그레고리 P. 윈터(67) 영국 케임브리지대 박사를 올해의 노벨 화학상 수상자로 선정했다고 밝혔다.
아놀드 교수는 효소의 유도 진화(directed evolution of enzymes)를, 스미스 교수와 윈터 박사는 항체와 펩타이드의 파지 전시(phage display of peptides and antibodies)를 연구한 공로로 올해 노벨화학상 수상의 영예를 안았다.
노벨위원회는“2018년 노벨화학상 수상자들은 인류를 가장 이롭게 하려는 목적으로 진화를 제어(control)하고 활용해 왔다”고 설명했다. 또 “수상자들은 진화의 힘에서 영감을 받았고 유전적 변화와 선택이라고 하는 동일한 원칙을 인류의 화학적 문제를 해결하는 단백질을 개발하는 데 활용했다”고 말했다.
조유희 차의과대 교수는“이번 수상자들의 연구는 인간에 없는 항체를 생산하는 데 활용되고 있다”며“류마티스 관절염 등 자가면역 질환을 치료하는 신약 휴미라가 대표적”이라고 말했다.
휴미라는 미국 제약사 애브비가 2002년 선보인 블록버스터 신약이다. 휴미라의 연간 매출은 지난해 기준으로 184억2700만 달러(20조6300억원)에 달한다. 세계적으로 가장 많이 팔린 처방약으로 꼽힌다. 류마티스 관절염이나 궤양성 대장염, 강직 척추염 등에 효과가 있다.
한편 미국 아놀드 교수는 9년 만에 탄생한 여성 노벨화학상 수상자가 됐다. 마리 퀴리(1911년 수상), 아다 요나트(2009년 수상) 등에 이어 역대 다섯 번째 여성 노벨화학상 수상자가 됐다. 아놀드 교수는 효소를 활용한 바이오 에너지 생성 연구에도 관여하고 있다. 그는 2005년 에너지 회사 제보(gevo)의 공동 창업자로 참여하기도 했다.
노벨위원회는 1일 생리의학상을 시작으로 2일 물리학상, 3일 화학상, 5일 평화상, 8일 경제학상 수상자를 발표한다. 올해는 ‘미투’(Me Too) 파문 논란으로 문학상 수상자는 1949년 이후 69년 만에 선정하지 않는다.
시상식은 알프레트 노벨의 기일인 12월 10일 스웨덴 스톡홀름(생리의학ㆍ물리ㆍ화학ㆍ경제학상)과 노르웨이 오슬로(평화상)에서 열릴 예정이다. 이번 수상자에게는 노벨상 메달과 증서, 900만 스웨덴 크로나(약 11억3000만원)의 상금이 수여된다. 900만 크로나 가운데 절반은 아놀드 교수가, 나머지 절반은 스미스 교수와 윈터 박사가 나눠 갖는다.
지난해 노벨화학상은 용액 내 생체분자를 고화질로 영상화할 수 있는 저온전자 현미경 관찰 기술을 개발한 자크 뒤보셰(스위스), 요아힘 프랑크(독일ㆍ미국), 리처드 헨더슨(영국)이 공동 수상했다.
http://www.hani.co.kr/arti/science/science_general/864463.html
시험관 속 진화원리, 값진 생체분자 만들다 – 2018 노벨화학상
[그림으로 보는 2018 노벨화학상]
미국·영국 생화학자 3명 수상 영예
박테리아-바이러스에 유전자 집어넣고
무작위 돌연변이와 선별 과정 되풀이
효소와 항체 분자들의 물질진화 이뤄
바이오연료, 항체약물 등 개발에 기여
올해 노벨 화학상의 영예는 무작위 돌연변이와 자연선택이라는 진화의 기본 원리를 응용해 의약과 산업 분야에서 유용한 효소와 항체 분자를 생산해내는 기법을 새롭게 연 3명의 과학자들한테 돌아갔다.
스웨덴 왕립과학원 노벨위원회는 3일 이런 업적을 이룬 공로로 미국 캘리포니아공대의 프랜시스 아널드(62) 교수와 미주리대의 조지 스미스(77) 교수, 영국 케임브리지대 분자생물학연구소의 그레고리 윈터(67) 연구원을 노벨화학상 수상자로 선정했다고 발표했다.
노벨위원회는 설명자료에서 이들이 창안한 기법 덕분에 더욱 효율이 뛰어나고 정교한 효소와 항체들이 만들어져 바이오연료와 의약 등 분야에서 널리 쓰일 수 있게 되었다고 전했다. 효소와 항체는 세포 안에서 유전자가 발현하여 만들어지는 단백질의 일종인데, 효소는 세포 안에서 일어나는 거의 모든 화학 반응을 매개하는 촉매로 작용하며, 항체는 항원과 특이적으로 결합해 우리 몸을 보호하면서 면역 반응을 일으키는 작용을 한다. 노벨위원회가 이들의 수상 업적으로 꼽은 ‘유도 진화’는 자연에서 일어나는 무작위 변이와 자연선택의 기본 원리를 수상자들이 독창적인 방법으로 실험실에서 구현해 뛰어난 생체 분자들이 만들어지는 데에 데 응용했음을 의미한다.
www.nobelprize.org/prizes/chemistry/2018 ▶바로가기
변이와 선별 거듭…효소분자의 진화
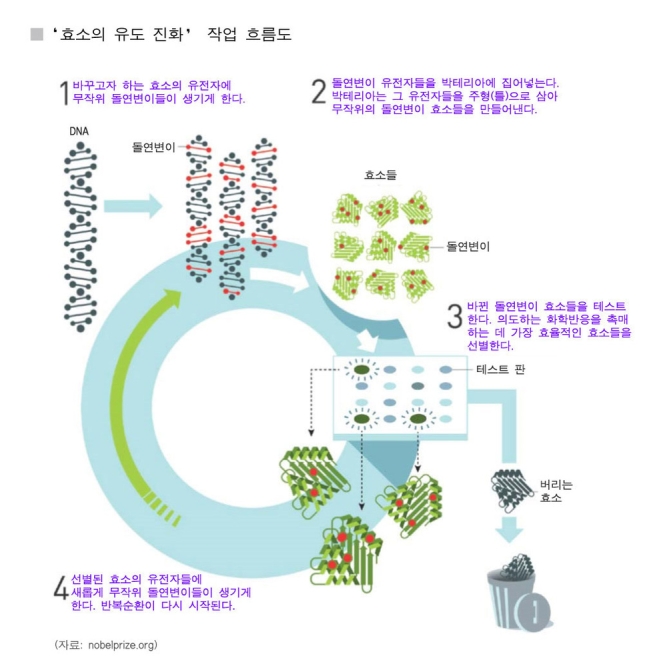
프랜시스 아널드는 미생물인 박테리아를 일종의 생화학 공장으로 이용해 더 뛰어난 효소 분자를 다량으로 만들어내는 길을 개척했다. 아널드는 1990년대 초부터 효소의 분자 구조를 개량하는 기존 방법에서 벗어나 살아 있는 박테리아 안에서 화학반응과 진화의 메커니즘을 일으켜 더 나은 효소를 개발하는 전에 없던 화학 공정을 연구했다.
여러 해의 연구를 거쳐 아널드가 개발해 제안한 방식은 효소 유전자의 무작위 돌연변이와 선별의 과정을 반복하면서 효소 분자의 진화를 유도하는 것이었다.
초기 연구에서, 아널드는 ‘서브틸리신’이라는 효소 분자의 유전자에다 무작위 변이를 일으켰고, 그 돌연변이 유전자들을 박테리아들에 집어넣어 수천 가지의 서브틸리신 효소 변이들을 만들어냈다. 이들 중에서 촉매 반응이 뛰어난 것을 선별해냈고, 그 다음에 선별된 효소들의 유전자에다 다시 무작위 변이를 일으켰다. 제2세대 변이 효소들 중에서 효능이 더 뛰어난 효소를 선별하는 과정을 되풀이했다.
3세대를 거친 뒤에 아널드는 원래의 효소보다 화학반응 촉매 능력이 256배나 커진 진화된 효소 분자를 얻을 수 있었다고 밝혔다. 실험실의 시험관에서 구현한 ‘유도된 진화’의 결과물이었다.
이후에 유도 진화 기법을 이용하는 여러 방법들이 더욱 발전했고, 이제는 바이오연료 생산과 제약 분야에도 이런 효소 생산 기법이 응용되고 있다고 노벨위원회는 설명했다.
바이러스 이용해 미지의 유전자 찾기
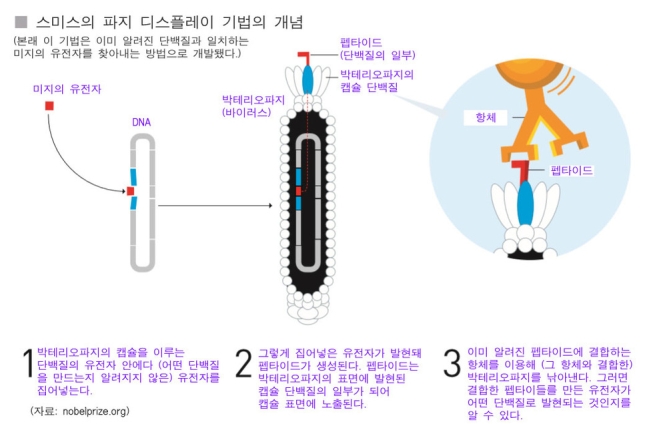
다른 수상자인 조지 스미스와 그레고리 윈터는 근래에 항체 약물을 개발하는 데 쓰이는 ‘파지 디스플레이’라는 기법을 창안하고 응용, 발전시킨 공로를 인정받았다. ‘파지(박테리오파지)’는 박테리아를 감염시키는 바이러스를 가리키는데, 파지 디스플레이는 이 바이러스의 본래 유전자에다 연구 대상 유전자를 집어넣고서 발현시켜 실험 결과를 얻기 위한 방법으로 개발됐다.
그러나 노벨위원회의 설명자료를 보면 원래의 파지 디스플레이는 항체 약물을 개발하는 기법으로 고안된 건 아니었다. 1980년대에 이 기법을 만든 조지 스미스는 당시에 그 기능이 알려지지 않은 수많은 미지의 유전자들 중에서 이미 알려진 단백질을 만들어내는 유전자가 어떤 것인지를 간편하게 식별해내는 방법으로 파지 디스플레이 기법을 고안해냈다. 연구자들이 알고 있는 어떤 단백질과 매칭 하는 유전자가 무엇인지를 찾아내는 데 이를 이용하고자 한 것이었다.
노벨위원회의 설명자료와 그림을 보면, 연구자는 먼저 박테리오파지의 유전체 중에서 바이러스 캡슐을 구성하는 단백질의 유전자에다 ‘미지의 유전자’ 조각을 집어넣는다. 그러면 집어넣은 유전자는 파지의 캡슐 단백질과 함께 발현해 바이러스의 껍질 표면에 펩타이드(작은 규모 단백질)로 노출된다. 많은 미지의 유전자들을 이런 식으로 바이러스 유전자에다 집어넣어 발현할 수 있다. 그렇게 되면 갖가지 펩타이드를 지닌 갖가지 바이러스들이 생겨날 것이다. 그런 다음에 이미 알고 있는 단백질 펩타이드에 잘 달라붙는 알려진 항체를 미지의 유전자들을 지닌 수많은 바이러스들의 용액에다 넣는다. 이렇게 해서 특정 항체가 달라붙은 박테리오파지만을 솎아낸다면, 이미 알려진 항체와 달라붙은 알려진 단백질이 어떤 유전자에서 만들어진 것인지를 비교적 간편하고 정확하게 식별해낼 수 있다는 것이다.
약물표적의 항체분자 찾아내고 진화 이끌기
박테리오파지와 항체를 이용한 스미스의 독창적인 유전자 매칭 기법은 당시에 그 자체로도 주목을 받았지만, 그 가치가 큰 빛을 발한 것은 아주 다른 용도로 쓰이면서 시작됐다고 노벨위원회는 전했다.
신약을 연구하던 그레고리 윈터는 스미스의 파지 디스플레이 기법을 이용하되 파지의 캡슐 유전자에다 무수히 많은 항체의 유전정보를 집어넣었다. 이렇게 하면 항체의 유전 정보는 박테리오파지의 캡슐 유전자와 함께 발현하는데, 이때에 항체에서 매우 중요한 부위인 ‘항원 결합 지점’이 바이러스의 껍질 표면에 잘 노출되었다. 서로 다른 항체 단백질들을 표면에 달고 있는 갖가지 바이러스들을 만들 수 있다는 것이다. 이런 특성은 항체 약물 개발에 큰 장점이 되었다.
그레고리는 1994년에 이런 방식으로 만든 무수히 많은 후보 항체들 중에서 특정한 암세포에만 특이적으로 잘 달라붙는 항체를 찾아내는 데 파지 디스플레이를 이용할 수 있음을 보여주었다. 더욱이 스미스가 개발한 효소 분자의 유도 진화 기법과 같은 원리를 사용하여 약물 표적과 잘 달라붙는 항체를 솎아낸 다음에 다시 그 항체에다 무작위 변이를 일으킴으로써 더 잘 달라붙는 항체 분자의 진화를 유도할 수 있었다. 그러면서 약물 표적에 훨씬 더 정확하게 더 강하게 결합하는 항체 약물을 개발하는 길이 열렸다.
이런 항체 약물 연구기법 덕분에 들은 현재 여러 자가면역질환의 치료제와 항암 치료제로 개발되었고 개발되고 있다.
노벨위원회는 “올해 노벨화학상 수상자들이 개발한 기법들은 현재 세계 여러 나라에서 발전하여 환경친화적인 화학산업을 진흥하고 신물질을 만들어내며 지속가능한 바이오연료를 제조하고 질병을 줄이며 생명을 구하는 데 쓰이고 있다”며 수상자 선정 이유를 밝혔다.
http://dongascience.donga.com/news/view/24273
[과학자가 해설하는 노벨상]인간에 이로운 맞춤형 단백질 만들다
이상엽 특훈교수. KAIST 제공.
올해 노벨화학상은 인간이 원하는 기능과 성능을 가진 단백질을 빠르게 만들고 찾아내는 기술에 주어졌다.
단백질은 세포내에서 다양한 기능을 수행한다. 누에 실크나 거미의 실크 단백질과 같은 구조단백질, 세포 내 반응을 촉진하거나 떨어뜨리는 효소, 면역에 관여하는 항체에 이르기까지 다양한 기능을 수행하는 살아있는 생명체에선 필수적인 구성 요소이다.
DNA로부터 RNA가 만들어지고 그로부터 단백질이 만들어지는 생물학의 기본 원리로부터 DNA서열에 변화가 생기면 단백질 서열도 달라지는 것은 오래 전부터 잘 알려져 있다. 실제 살아있는 생명체는 DNA에 변이(혹은 복제시 오류)를 통해 다양한 변형된 단백질들을 만들고 이런 변이 단백질들을 가진 세포나 그 세포들로 구성된 개체들 중 주어진 환경에서 더 잘 살아남는 개체들로 진화해왔다.
1970년대 유전자 재조합 기술이 등장하면서 인간 유전자를 박테리아와 같은 미생물에서 발현시켜 단백질을 대량생산하는 방법이 제시됐고 1990년대 들어 세포의 대사네트워크 전체를 재설계해 유용한 화학물질을 생산하는 대사공학으로 발전했다. 대사공학에선 효소를 잘 만들어 세포 내에서 적정량으로 발현하도록 해주는 것은 필수적이다.
이전에는 대사공학에서 사용하는 효소들을 자연계에서 찾아 활용했다. 하지만 우리가 유용 연료, 고분자, 용매, 의약품으로 사용하는 화학물질을 효율적으로 생산하는데 효소의 성능이나 기능이 제한적인 경우가 많았다. 올해 노벨 화학상을 수상한 두 가지 기술들, 즉 ‘유도진화(directedevolution)’과 ‘파지 디스플레이(phage display)’기술은 이런 문제를 해결하는데 결정적 역할을 했다.
올해 수상자 중 한 명인 프랜시스 아널드 미국 캘리포니아공대 교수가 유도진화 기술을 개발한 시점은 윌렘 핌 스테머(Willem Pim Stemmer) 박사(2013년 작고)가 DNA 셔플링(DNAshuffling)이라는 기술을 개발한 시점과 공교롭게 비슷하다. 이들 두 기술은 단백질 유도진화에 획기적인 발전을 가져왔다는 평가를 받고 있다. 두 기술 모두 단백질을 만드는 청사진을 제공하는 DNA 서열을 실험실에서 빠르게, 많은 종류로 변이를 시킨 후 발현시켜 수많은 종류의 단백질 라이브러리를 만들고, 그 중에서 원하는 기능을 가진 단백질을 빠르게 검색하는 기술이다. 자연 진화를 통해 얻는 단백질 종류보다 훨씬 많은 종류의 단백질을 빠르게 만들어 낼 수 있어 원하는 단백질을 찾아낼 확률이 높다.
특히 이 기술은 단백질의 특정 부위만을 집중적으로 변이를 줘서 찾는 방식으로 진화하는 등 더욱 다양한 기술로 발전했다. ‘유도진화’는 필자와 같이 대사공학 연구를 하는 사람뿐 아니라 단백질을 다루는 대부분의 과학자에게 필수적으로 사용되는 기술이 됐다. 생체시스템이나 그 일부를 활용하여 화학물질이나 의약품 등 유용물질들을 바이오 기반으로 만들 때 핵심적으로 쓰이는 기술인 것이다.
올해 노벨 화학상의 또 다른 주인공인 조지 스미스 미국 미주리대 교수와 그레고리 윈터 경(영국 케임브리지대 교수)이 개발한 ‘파지 디스플레이’기술에서 파지(박테리오파지 약자)는 동식물세포를 감염시키는 바이러스처럼 박테리아를 감염시킨다. 파지는 자기 복제를 위해 바이러스처럼 숙주세포가 필요한데 바로 이 숙주세포가 박테리아인 것이다. 최근 유전체 편집 도구로서 각광을 받고 있는 크리스퍼(CRISPR)기술은 박테리아가 파지의 감염으로부터 방어하기 위해 작동시키는 시스템 중 하나다.
파지의 DNA에 의해 코딩되는 유전자 중에는 파지의 표면단백질을 만드는 것들도 있다. 이 표면단백질 유전자에 우리가 원하는 단백질을 만드는 유전자 서열을 함께 연결해서 발현시키면 파지는 그 유전자가 뭔지도 모른채 발현하며, 이렇게 만들어진 재조합단백질이 파지의 표면에 나타난다. 예를 들어 항체 일부 중 항원을 인식하는 부위를 코딩하는 유전자를 함께 연결하여 발현시키면 그 항체의 일부가 파지 표면에 발현이 되는 것이다. 이 항체 유전자 서열을 ‘유도진화’ 경우처럼 많은 종류로 변이를 주어 발현시키면 다양한 항원인식 항체 부위를 라이브러리 형태로 생성할 수 있고 이들을 빠르게 검사해서 원하는 항체를 얻을 수 있는 것이다.
실제 이 기술을 써서 만들어진 항체의약품인 아달리무맙(상표명 휴미라)은 류마티스 관절염 같은 면역질환을 치료하는 블록버스터 생물의약품으로서 큰 획을 그었다. 파지 디스플레이 기술은 그후 필자도 연구를 해온 세포표면발현(cell surface display)기술 등으로 변신하며 ‘유도진화’기술과 더불어 대사공학을 포함한 생명공학 전반에서 널리 활용되고 있다.
올해 노벨 화학상을 받은 기술을 오랜 기간 활용해 온 필자로서는 감회가 남다르다. 유도진화 기술을 개발한 프랜시스 아널드 교수가 국제학회와 여러 자문위원회에서 자주 만나는 친구라는 점도 그렇지만 필자와 같은 화학공학자라는 점에서 더욱 뜻깊다. 발표가 나는 순간 대사공학이라는 훨씬 더 복잡한 전략을 개발하고 유용한 물질을 만들어내기 위해 밤낮없이 연구하는 제자들 생각이 제일 먼저 났다. 그리고 머리에 이런 생각이 떠올랐다. “나의 사랑하는 제자들, 나중에 너희들 중에서 노벨 화학상 수상자가 나올 것만 같다.”
효소의 방향적 진화 관련 논문 세 편
프란시스 아놀드 박사의 1998년 Accounts of Chemical Research 논문: 여기를 클릭하세요~
ETH의 도널드 힐버트 박사의 2018년 Annual Reviews of Biochemistry 논문: 여기를 클릭하세요~
화학공학소재연구정보센터에 공개되어 있는 한글 설명 논문: 여기를 클릭하세요~
파지 디스플레이(phage display) 원리(youtube)
http://www.viva100.com/main/view.php?key=20160808020017433
전세계 매출 톱10 중 3개는 TNF억제제 … ‘휴미라’ vs ‘엔브렐’ vs ‘레미케이드’
미국 통계 전문사이트 ‘스태티스타’가 조사한 지난해 의약품 세계 매출 순위에 따르면 종양괴사인자(TNF, tumor necrosis factor)억제제인 애브비의 ‘휴미라’(성분명 아달리무맙, adalimumab)가 149억5000만달러(약 16조6438억원)로 2위, 암젠의 ‘엔브렐’(성분명 에타너셉트, etanercept, 화이자 공동판매)이 94억7000만달러(약 10조5430억원) 4위, 얀센의 ‘레미케이드’(성분명 인플릭시맵, infliximab)가 82억달러(약 9조1291억원) 6위로 최상위권에 다수 포진해 있다.
건강보험심사평가원이 분석한 건강보험 의약품 청구실적에 따르면 지난해 TNF억제제 계열 바이오의약품의 국내 매출은 1348억원으로 전년 1151억원 대비 17.1% 증가했다. 휴미라의 경우 2014년 448억원에서 지난해 510억원으로 전년 대비 처방액이 13.8% 늘었다. 엔브렐은 2014년 299억원에서 지난해 325억원으로 전년 대비 매출이 8.7% 상승했다. 레미케이드는 2014년 294억원에서 지난해 317억원으로 전년 대비 처방액이 7.8% 증가했다.
TNF억제제는 종양괴사인자(TNF)가 TNF수용체에 결합하지 못하도록 방해한다. TNF억제제가 TNF와 결합하면 염증반응을 일으키는 신호전달 과정이 차단됨으로써 염증 억제 효과가 나타나게 된다. 이들 바이오의약품은 면역세포가 자신의 관절을 스스로 공격하는 류마티스관절염(RA, Rheumatoid Arthritis) 등 자가면역질환 치료에서 기존 화학약품보다 치료 효과가 빠르게 나타나고 환자의 만족도도 높은 것으로 알려져 있다.
엔브렐은 1998년 미국 식품의약국(FDA)으로부터 생물학적제제 중 세계 최초의 류마티스관절염치료제로 승인받았다. 이 약은 암젠이 개발하고 화이자가 판매하고 있다.
류마티스관절염은 초기에 관절을 싸고 있는 활막에 염증이 발생한 후 점차 주위의 연골·뼈로 염증이 퍼져 관절의 파괴와 변형을 초래한다. 연령 증가에 따른 관절의 반복적인 사용, 외상에 의한 관절 연골의 노화가 주요 원인인 퇴행성관절염과 달리 류마티스관절염은 어느날 갑자기 찾아온다. 발병 원인은 아직 정확하게 밝혀지지 않았다. 류마티스관절염이 퇴행성관절염보다 무서운 이유는 무시무시한 통증 자체보다 합병증에 있다. 관절 활막에 생긴 염증은 관절손상에 그치지 않고 동맥경화·골다공증·세균감염으로까지 이어질 수 있다.
미국 류마티스학회(ACR, American College of Rheumatology)가 규정한 류마티스 치료법의 유효성 평가지수 ACR20은 총 7가지 항목 중 △통증 관절수 △종창 관절수 등 증상 관련 2가지 항목이 모두 20% 이상 개선되고 △환자 자신의 통증 평가(시각상사척도 또는 시각적통증시수(VAS, Visual analogue scale) 이용) △환자의 질환 활동성 평가(VAS 이용) △의사의 질환 활동성 평가(VAS 이용) △환자의 신체기능 평가(VAS 이용) △C반응성단백(CRP, C-reactive protein) 또는 적혈구침강속도(ESR, erythrocyte sedimentation rate) 급성기반응물질 측정 등 나머지 5항목 중 3항목 이상이 20% 이상 개선된 상태를 의미한다. ACR50, ACR70은 관련 증상이 50%, 70% 이상 개선된 상태를 뜻한다.
종창은 세포수가 증가하지 않은 채로 신체 일부분에 염증·종양 등으로 인해 곪거나 부어오른 것을 말한다. 급성기반응물질은 염증(감염·자가면역질환 등)이나 조직손상(외상·수술·심근경색·종양)에 반응해 양이 증가하거나 감소하는 물질을 뜻한다.
최근에는 메토트렉세이트(MTX, methotrexate)를 포함한 기존 항류마티스제제(DMARDs, Disease Modifying Anti-Rheumatic Drugs)와 TNF억제제를 병용해 치료하는 추세다. 항류마티스제제는 염증 억제 효과가 투여 한 달 후에 나타나기 시작해 6개월 후에 최대 효과를 보여 효능 발현이 늦다. 항류마티스제제로 단독 치료한 경우 X-레이 사진을 찍은 결과 병의 진행을 충분히 막지 못하는 한계가 있는 반면 TNF억제제는 병의 진행을 억제하는 효과가 있는 것으로 알려져 있다.
TNF는 활성화된 대식세포, 자연살해세포(NK cell, natural killer cell), T림프구(면역세포), 종양세포로부터 생산되는 사이토키닌(cytokinin)의 일종이다. 생체 내에서 특정 종양에 출혈성 괴사를 유도하는 인자로 발견됐다. TNF는 세포막에 결합된 형태와 종양괴사인자전환효소(TACE)에 의해 세포막에서 떨어져 혈액 속을 떠다니는 유리형(free form)으로 존재한다. TNF는 혈중 TNF수용체 2가지 가운데 p55 또는 p75와 결합해 염증반응을 일으킨다.
과잉 생산된 TNF는 류마티스관절염 환자의 대식세포를 자극해 연골·뼈·인대 세포 등에 과도한 염증반응을 유발함으로써 증상을 악화시킨다.
정상적인 TNF는 염증반응과 후천성·선천성 면역에 중요한 역할을 담당한다. 이에 TNF억제제는 체내 면역능력을 떨어뜨려 결핵 등 감염과 림프종 발생 위험을 증가시킬 수 있다. 영국 류마티스생물의약품학회(BSRBR, British Society for Rheumatology Biologics Register)가 2010년 발표한 류마티스치료제 복용에 따른 결핵유발률은 4년 경과 후 1% 미만 수준이긴 하나 휴미라, 레미케이드, 엔브렐, DMARDs순으로 높았다.
또 생물학적제제는 장기 투여하다보면 약물 자체에 맞서는 항체가 생겨 약효가 떨어질 수 있다.
 |
| TNF억제제 ‘휴미라’ vs ‘엔브렐’ vs ‘레미케이드’ 3종 비교표 |
기전 상 특징
휴미라는 최초로 100% 인간 유전자를 재조합한 면역글로불린G(IgG) 단일클론항체다. 엔브렐은 면역글로불린G 항체의 고정부위(Fc)와 인간 TNF수용체(p75)를 융합한 단백제제다. 레미케이드는 사람·쥐 키메라(이종결합) 항체다. TNF에 달라붙는 항원결합부위(Fab)는 쥐 단백질로, 실질적인 항체반응을 나타내는 고정부위는 사람단백질로 구성돼 있다.
레미케이드는 전체 구성 성분의 25%가 쥐에서 유래된 항체이기 때문에 이를 공격하는 다른 항체물질이 몸에서 더 많이 생겨나 약효가 떨어지는 정도가 휴미라·엔브렐보다 더 크다. 키메라항체 발생으로 인한 면역반응을 줄이기 위해 MTX 등과 반드시 병용투여해야 한다.
휴미라와 레미케이드는 혈액 속 떠다니는 유리형과 세포막에 붙은 부착형 TNF에 모두 결합하는 반면 엔브렐은 혈액 속에 떠다니는 TNF만을 포획한다. 이에 엔브렐은 휴미라·레미케이드보다 염증 억제효과가 떨어질 수 있으나 결핵유발률이 낮은 장점이 있다.
TNF수용체는 세포막에 붙어 있는 경우에만 신호를 전달해 염증을 유발하기 때문에 이론적으로는 혈액 속에 부유하는 TNF를 붙잡아도 염증이 완화되는 것은 아니지만 염증반응 시 이렇게 해서라도 TNF 수를 줄여놓으면 염증이 가라앉는 직간접 효과를 거둘 수 있다.
반감기는 휴미라가 11∼13.7일, 레미케이드 8~9.5일, 엔브렐 4일 순으로 길다. 이상훈 강동경희대병원 류마티스내과 교수는 “엔브렐은 반감기가 짧아 체내에서 빠르게 배출된다”며 “감염 및 임신 등 다양한 임상 상황에서 이점이 크다”고 말했다.
사용법
휴미라 40㎎의 급여가는 약 42만3000원으로 환자는 이 중 10%만 부담하면 된다. 이들 세 약제 중 가장 비싸지만 투여편의성이 높은 게 큰 장점이다. 40㎎을 2주에 1회 피하주사한다. 병원 방문 없이 자가투여가 가능하다. 주사기 속에 약이 미리 충전돼 있는 프리필드시린지 형태로 출시돼 정확한 용량을 투여할 수 있다. 또 다른 주사제형의 펜 타입은 환부에 대고 클릭하면 주사바늘이 순간 나왔다 들어가면서 약물이 주입돼 주사에 대한 공포감을 줄일 수 있다.
휴미라는 2007년 류마티스관절염치료제로 국내 첫 출시됐다. 이밖에 건선 및 건선성관절염, 강직성척추염, 크론병, 궤양성대장염, 베체트장염, 화농성한선염, 소아 특발성관절염, 소아 골부착부위염 관련 관절염 등 셋 중 가장 많은 적응증을 갖고 있다. 한국애브비와 한국에자이가 공동 판매하고 있다.
엔브렐 50㎎와 25㎎의 급여가는 각각 약 15만원, 약 8만5400원으로 환자는 여기서 10%만 부담하면 된다. 50㎎을 주 1회 또는 25㎎을 주 2회 피하주사한다. 병원 방문 없이 자가투여가 가능한 게 큰 장점이다. 주사기 속에 약이 미리 충전돼 있는 프리필드시린지 형태로 편의성이 높고 정확한 용량을 투여할 수 있다.
엔브렐은 2003년 류마티스관절염치료제로 국내 첫 출시됐다. 이밖에 건선 및 건선성관절염, 강직성척추염, 소아 특발성관절염 등 적응증을 갖고 있다.
레미케이드 100㎎의 급여가는 약 38만3000원으로 환자는 여기서 10%만 부담하면 된다. 3㎎/㎏(환자 체중 당 투여량)을 0, 2, 6주 간격으로 3회 정맥주사로 투여 후 매 8주마다 3㎎/㎏을 투여한다. 투여주기가 2개월로 가장 길다. 이 약은 최초 3회 투여 시 3㎎/㎏을 약 2시간 이상에 걸쳐 정맥 주입한다. 첫 3회의 2시간 주입 시 이상반응이 없는 류마티스관절염 환자 중 선별해 이후 정맥주입에서는 주입시간을 1시간 이내로 단축하는 것을 고려해 볼 수 있다.
레미케이드는 1998년 크론병치료제로 미국 FDA의 허가를 받은 최초 생물학적제제로 이듬해 류마티스관절염치료제 등으로 추가 승인을 받았다. 국내에서는 크론병, 류마티스관절염, 건선 및 건선성관절염, 강직성척추염, 궤양성대장염 등에 대해 적응증을 획득했다. 2011년 7월 한국얀센은 미국 본사 존슨앤드존슨과 MSD의 합의에 따라 한국MSD로부터 레미케이드 판권을 양수했다.
임상결과
휴미라
애브비는 임상 ‘ARMADA’에서 MTX에 반응하지 않는 불응성 류마티스관절염 환자 대상으로 휴미라·MTX 병용군과 위약·MTX를 병용 투여한 위약군으로 나눠 치료효과를 비교했다. 연구결과 24주 후 ACR20 반응률은 휴미라 투여군이 67.2%로 위약군 14.5%에 비해 높았다. 휴미라 투여군의 ACR50 반응률은 55.2%, ACR70은 26.9%로 위약군 대비 우월한 효과를 나타냈다.
휴미라·MTX 병용군과 MTX 단독 투여군의 부작용 발현빈도는 비슷했다. 4년간 장기추적한 임상결과 휴미라와 MTX를 사용했을 때 심각한 부작용 발생이 증가하지 않았으며 스테로이드 또는 MTX 사용량을 줄여도 임상적 관해가 유지된 것으로 확인됐다.
국내 6개 대학병원에서 류마티스관절염 치료를 받고 있는 환자 128명을 대상으로 조사한 결과 휴미라·MTX 병용군의 경우 치료 24주 후 관절염 임상 증상이 50% 이상 개선(ACR50)된 환자가 43.1%에 달했으나 위약·MTX 병용한 위약군은 14.3%에 불과했다.
엔브렐
초기 류마티스관절염 환자 411명을 대상으로 실시한 ‘COMET’ 임상결과 치료 2년 후 엔브렐·MTX 병용군의 57%가 임상적 관해 상태에 도달한 반면 MTX 단독 투여군의 경우 35%만 임상적 관해에 도달했다. 지속적으로 병용 투여한 환자군의 90%에서 관절 손상 진행 여부 판단에 중요한 기준인 방사선적 진행이 관찰되지 않았다
다른 임상 ‘TEMPO’에서는 엔브렐·MTX 병용 투여군의 치료 52주 후 ACR20, ACR50, ACR70 반응률이 각각 85%, 69%, 43%로 나타나 엔브렐, MTX 단독 투여군에 비해 우수한 치료효과가 확인됐다.
레미케이드
송영욱 서울대병원 류마티스내과 교수는 “‘ATTRACT’ 임상결과 MTX를 단독 투여한 환자의 관절 손상 진행 비율이 31%인 반면 레미케이드를 처방받은 환자의 경우 0~13%에 불과했다”고 설명했다.
증상 호전은 레미케이드를 투여한 지 2주 후부터 시작돼 연구 종료 시점인 102주까지 지속됐다. 54주 후와 102주 후에 방사선 검사로 손가락·손목·발가락 관절의 손상 정도를 비교한 결과 구조적 손상이 진행되지 않은 것으로 확인됐다.
다른 ‘ASPIRE’ 임상에서는 레미케이드·MTX 병용군의 54주 후 ACR20 반응률은 62%로 위약·MTX를 병용 투여한 위약군 54%에 비해 높았다. 레미케이드 투여군의 ACR50과 ACR70 반응률은 각각 46%와 33%로 위약군의 ACR50 32%, ACR70 21%보다 우수한 치료효과가 확인됐다.
배상철 한양대병원 류마티스내과 교수는 “생물학적제제는 작용원리와 사용법에서 차별성을 보이나 실제 임상치료에선 효과 차이가 크지 않다”며 “결국 의사의 경험을 바탕으로 환자에게 가장 적합한 것을 선택하게 된다”고 말했다.
이들 세 TNF억제제는 최근 특허가 만료됐거나 조만간 만료될 예정으로 셀트리온, 삼성바이오에피스, 암젠, MSD, 화이자 등 국내외 제약·바이오업체들이 오리지널에 도전장을 내밀고 있다. 레미케이드는 유럽 특허가 2013년, 미국 특허는 2015년 만료됐다. 셀트리온은 레미케이드의 바이오시밀러(복제약) ‘램시마’를 유럽 및 국내에 출시했으며, 지난 4월 미국 FDA로부터 이 약의 판매 승인을 받았다. 엔브렐은 지난해 유럽 특허가 만료됐으며 미국에선 2028년까지 만료기한이 연장됐다. 휴미라는 미국에선 올해 말 특허가 만료되며 유럽에선 2022년까지 만료기한이 연장됐다.
http://dongascience.donga.com/news/view/24264
기사작위 받은 히트약 개발자,反시온주의 외친 참여과학자…노벨화학상 수상자 별별이력
올해 노벨 화학상을 받은 프랜시스 아널드 미국 캘리포니아공대 교수(62·여)와 조지 스미스(77) 미국 미주리대 교수(77), 그레고리 윈터 경(67·영국 케임브리지대 교수)은 획기적인 연구 성과뿐 아니라 독특한 이력이 주목을 받고 있다. 이보다 앞서 지난 3일 스웨덴 왕립과학원 노벨상 선정위원회는 다윈의 진화론을 세균을 키우는 시험관에 적용해 인류에게 엄청난 이익을 가져다준 세 사람을 올해 노벨 화학상 수상자로 선정했다고 밝혔다.

프랜시스 아놀드 캘리포니아공대(칼텍) 교수
●암 극복한 세 아이 엄마, 여성 최초로 세계 최고 기술상 받아
아널드 교수는 생명 과학의 발전에도 지대한 업적을 쌓아왔지만, 여성 과학자로서도 힘든 길을 걸어왔다. 세 아들의 엄마이기도 한 아널드 교수는 남자 교수들이 대다수인 캘리포니아공대에서 9번째로 임명된 여성 교수다. 그는 48세이던 2005년 유방암을 진단을 받았지만 1년6개월간의 힘겨운 항암치료 끝에 완치판정을 받았다. 암 치료를 받으면서도 연구를 놓지 않았다.
아널드 다양한 수상 경력이 있지만 그중에서도 지난 2016년 세계에서 가장 권위있는 기술상으로 불리는 ‘밀레니엄 기술상(Millennium Technology Prize)’을 여성 최초로 받은 이력이 있다. 당시 주최 측은 “독보적인 후보자가 아널드 교수 한 명 뿐이었다”고 밝히기도 했다.
아널드 교수는 언론과 인터뷰에서 “능력 있는 더 많은 젊은 여성들이 기술 분야에 뛰어 들고 있다”며 “특히 화학과 생물공학 분야에서 몇몇 여성 과학자들이 톱레벨에 이르렀으며, 30년에 더 많은 여성 과학자들이 큰 상을 받을 것”이라고 말했다.

그레고리 윈터 경
●기사 작위 받은 세계 매출 1위 의약품 개발자
그레고리 윈터 영국 케임브리지대 및 분자생물학연구소 교수는 영국 왕실로부터 1997년엔 ‘대영제국 지휘관 훈장’을, 2004년엔 ‘기사작위(Knight Bachelor)’를 받은 저명한 과학자다. 하지만 윈터 교수를 전 세계에 더 유명하게 만든 건 류마티스 관절염 치료제인 ‘휴미라(Humira)’다.
파지 디스플레이라는 기술을 개발한 그는 호주의 작은 회사로부터 75만 파운드를 투자받아 동료 연구원 데이비드 크리스웰 연구원과 ‘캠브리지 항체 기술(CAT)’이라는 벤처 기업을 만들었다. 그가 처음부터 창업을 하고 싶었던 건 아니었다. 그러나 자신의 연구를 지속하기 위해서는 연구비가 필요했고, 투자자 측이 창업을 권유하면서 이뤄지게 됐다.
CAT은 본의 아니게 세워졌지만 최초의 인간 치료용 항체인 ‘휴미라’를 개발하며 대박을 터트리게 된다. 휴미라는 현재 전 세계에서 매출 1위를 차지하고 있다. CAT는 지난 2006년 영국 제약회사인 아스트라제네카에 7억2000만 파운드(약 1조459억원)에 인수됐다. 기초연구에서 시작해 창업 17년 만에 초기 투자금의 1000배에 달하는 가치를 달성한 것이다. 이는 영국 과학계에서도 손꼽히는 성공 사례다.

수상자 발표 직후 조지 스미스 교수. 이른 아침 집에서 전화를 받고 있다.
●반(反)이스라엘 활동하는 참여형 과학자
조지 스미스 미국 미주리대 생물학 교수는 이스라엘을 비판하는 정치 활동을 활발히 하는 사회참여형 과학자다. 이스라엘군이 팔레스타인 지역을 공격하는 행위를 신랄하게 비판하는 행위를 서슴지 않으며, 지난 2015년 초 한 이스라엘군 예비역이 이스라엘을 옹호하는 연설을 하자 관객석에서 공개적으로 야유를 퍼부으며 비난하기도 했다.
나아가 그해 6월엔 자신의 전공과는 무관한 ‘시온주의에 대한 관점’이란 교과목을 대학 내 개설하겠다고 신청했다가 한 차례 논란을 불러일으키기도 했다. ‘교수 개인의 편향적인 시각으로 하는 강의는 개설되지 말아야 한다’는 지적이 계속돼 결국 강의가 열리진 않았지만, 그의 반이스라엘에 활동은 지금도 계속 되고 있다.