면역항암제 연구분야 연구자인 제임스 앨리슨과 혼조 다스쿠가 2018년 노벨생리의학상을 수상했군요^^
(원문: 여기를 클릭하세요~)
James Allison and Tasuku Honjo pioneered treatments that unleash the body’s own immune system to attack cancer cells.
James Allison and Tasuku Honjo share the 2018 Nobel Prize in Physiology or Medicine.Left: Richard Drew/AP/Shutterstock. Right: MEXT/CC BY 4.0
Two scientists who pioneered an entirely new way to treat cancer have won the 2018 Nobel Prize in Physiology or Medicine.
James Allison at the University of Texas MD Anderson Cancer Center in Houston and Tasuku Honjo at Kyoto University in Japan will share the 9 million Swedish kronor (US$1 million) prize.
The pair showed how proteins on immune cells can be used to manipulate the immune system so that it attacks cancer cells. The approach has since led to the development of therapies that have been hailed for extending survival in some people with cancer by years, and even wiped out all signs of disease in some people with advanced cancers. Researchers have flocked to the approach, and immunotherapy is now one of the hottest areas in cancer research.
Early excitement
Allison is in New York for an immunology conference, and was awoken at 5.30 by a call from his son delivering the good news. By 6.30, colleagues were banging on the door of his hotel room bearing champagne for an impromptu party. The Nobel Committee only reached him some time after that.
“It still hasn’t completely dawned on me,” said Allison, at a press conference. “I was a basic scientist. To have my work really impact people is one of the best things I could think about. It’s everybody’s dream.”
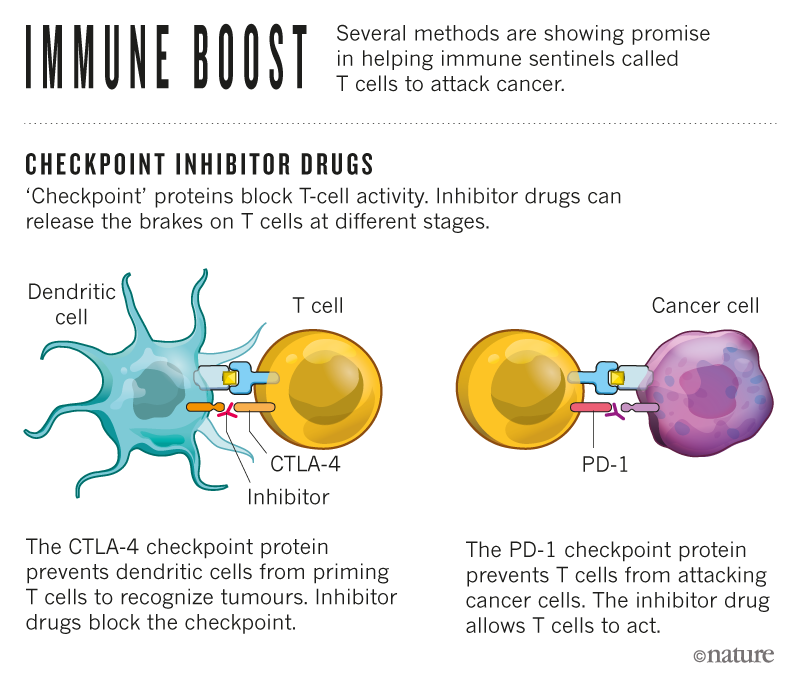
In the 1990s, Allison, then at the University of California, Berkeley, was one of several scientists who studied a ‘checkpoint’ protein, CTLA-4, that acts as a brake on immune cells called T cells. In 1997, Allison and his colleagues engineered an antibody that could bind to CTLA-4, removing the brakes on T-cell activity and unleashing them to attack cancer cells in mice. A clinical study in 2010 found that the antibody had a striking effect on people with advanced melanoma, a form of skin cancer1.
Working independently of Allison, in 1992, Honjo discovered a different T-cell protein, PD-1, which also acts as a brake on the immune system but by a different mechanism. PD-1 went on to become a target in the treatment of cancer. In 2012, research in people revealed that the protein was effective against several different cancers, including lung cancer, a major killer2. The results were dramatic — some patients with metastatic cancer went into long-term remission, raising the possibility of a cure.
Releasing the brakes
“Allison’s and Honjo’s discoveries have added a new pillar in cancer therapy. It represents a completely new principle, because unlike previous strategies, it is not based on targeting the cancer cells, but rather the brakes — the checkpoints — of the host immune system”, said Klas Kärre, a member of the Nobel Committee and an immunologist at the Karolinska Institute in Stockholm who described the work of the prizewinners during the Nobel announcement. “The seminal discoveries by the two laureates constitutes a paradigmatic shift and a landmark in the fight against cancer.”
In recent years, clinical work on drugs that inhibit the CTLA-4 and PD-1 mechanisms — known as ‘immune checkpoint therapy’ — has developed apace. Treatments that block PD-1 have been shown to be effective in lung and renal cancers, lymphomas and melanoma. Recent clinical work that combined therapies targeting CTLA-4 and PD-1 in patients with melanoma showed that this approach can be even more effective than CTLA-4 alone3. Trials are now underway to evaluate the efficacy of checkpoint therapy against most types of cancer, and scientists are testing numerous other checkpoint proteins to see if they could act as targets.
But Allison and Honjo were not alone: others also made important early discoveries about checkpoint inhibitors, notes Gordon Freeman, an immunologist at the Dana-Farber Cancer Institute in Boston, Massachusetts, who was disappointed not to be recognized for his contributions. Freeman, along with immunologists Arlene Sharpe at Harvard Medical School in Boston and Lieping Chen at Yale University in New Haven, Connecticut, studied PD-1 and a molecule that binds to it called PD-L1.
The drug ipilimumab, an antibody that inhibits CTLA-4, won approval from the US Food and Drug Administration (FDA) in 2011 and was the first checkpoint inhibitor to reach patients. But Freeman points out that CTLA-4 inhibitors have so far been shown to work only in melanoma. And the FDA has approved drugs that target PD-1 and PD-L1 to treat 13 different cancers. “PD-1 and PD-L1 are what works in a really wide variety of people,” he says. “And our discoveries were foundational there.”
However, Freeman says that CTLA-4 paved the way, and that Allison had a key role in pushing the field. “Jim Allison has been a real advocate and champion of the idea of immunotherapy,” he says. “And CTLA-4 was a first success.”
Obvious choices
Immunologist Jerome Galon of the French national biomedical research agency, INSERM, in Paris, was not surprised by the committee’s decision to award the prize to Honjo and Allison. “I think they really deserve it,” he says. “You can always multiply and have many other people, but these are the obvious two first choices.”
He adds that the prize reflects how far the immune approach to fighting cancer has come. When PD-1 inhibitors were shown to work against lung cancer in 2012, the field ignited, with researchers in academia and industry racing to find ways to expand the number of patients who could benefit from the drugs. “Ten years back, nobody was interested — nobody except a few immunologists,” Galon says. “It’s such a big change.”
In a 2013 interview with Nature, Allison described the resistance he met when he first tried to get pharmaceutical companies interested. “It was very frustrating,” he said. “They said, ‘It may work in mice, but it’ll never work in people’. The concept was new and it was so unusual.”
Allison marched from company to company in search of one that would take on the project. Ultimately, Bristol-Myers Squibb of New York City was the one to push ipilimumab over the finishing line. Since then, other pharmaceutical companies have developed checkpoint inhibitors that have been approved for use in people.
Combination therapy
A major draw, says Galon, is the potential of these drugs to lengthen patients’ lives by years, rather than just weeks or months. But only a fraction of patients experiences such dramatic responses, and researchers are racing to boost those numbers by combining checkpoint inhibitors with each other and with other treatments. “The huge benefit in comparison to other treatments is that patients are experiencing long-term survival,” he says. “Unfortunately, only a subgroup of patients is responding.”
Through it all, it’s been thrilling to watch the field develop, says Freeman. “It’s really been just an incredible amount of human creativity and energy,” he says. “It’s wonderful because so many cancer patients are doing better.”
In 2015, Allison won a prestigious Lasker prize for his work on cancer immunotherapy. In 2016, Honjo won the Kyoto Prize in basic sciences, a global prize awarded by the Inamori Foundation.
http://biz.chosun.com/site/data/html_dir/2018/10/01/2018100103159.html
3세대 암(癌)치료 문 연 美·日 과학자들 노벨의학상 수상…’면역 관문 수용체’ 기능 규명
올해 노벨 생리의학상은 최근 암(癌)정복의 열쇠로 떠오른 ‘면역기전’을 발견하고 기능을 밝혀낸 미국과 일본 의학자 2명에게 돌아갔다.
암세포가 몸을 숨는 데 도움을 주는 단백질 ‘PD-1’· ‘CTLA4’ 등의 작용을 차단하고 면역세포를 활성화시켜 암세포를 공격할 수 있는 면역체계 메커니즘을 규명한 공로다.
스웨덴 카롤린스카 의대 노벨위원회는 1일(현지시각) 이러한 업적을 세운 제임스 앨리슨(James P Allison) 미국 텍사스 MD 앤더슨 암센터 교수와 혼조 다스쿠(本庶佑·76) 일본 교토대 의과대학 교수 등 2명을 노벨 생리의학상 공동 수상자로 선정했다고 밝혔다.
노벨위원회는 “매년 수백만명의 사람들을 죽이는 암은 인류의 가장 큰 건강 문제 중 하나”라며 “(두 연구자는) 암 세포를 공격하는 우리의 면역체계와 기능을 규명해, 암치료의 새로운 패러다임을 세웠다”고 밝혔다.

2018년 노벨 생리의학상 수상자로 제임스 앨리슨(James P Allison) 미국 텍사스 MD 앤더슨 암센터 교수와 혼조 다스쿠(本庶佑·76) 일본 교토대 의과대학 교수가 선정됐다.(왼쪽부터) / 노벨위원회 제공
암(癌) 치료 패러다임은 1세대 화학항암제, 2세대 표적항암제를 거쳐 3세대 면역항암제 치료까지 발전했다. 기존의 항암제가 암세포를 직접 겨냥했다면, 새롭게 등장한 면역항암제는 면역세포를 활성화시켜 암세포를 사멸시킨다. 인체의 면역체계 기전을 바탕으로 개발된 면역항암제는 뾰족한 해법이 없었던 암 환자들에게 치료 효과를 보이면서 암 정복의 열쇠로 최근 급부상했다.
바로 올해 노벨생리의학상을 수상한 두명의 과학자가 3세대 암 치료의 문을 연 것이다. 두 과학자는인체 면역기전에 있어서 ‘면역관문수용체(immune checkpointreceptor)’를 발견하고 그 기능을 밝혔다.
면역관문수용체는 면역기능을 활성화 또는 비활성화 시키는 일종의 스위치 역할을 하는 수용체다.면역기능을 일정시간 동안 작동시키고, 일정시간 동안만 면역기능을 최대한 활성화시켜 인체의 방어기능을 작동하게 한다. 또 지나친 면역 활성으로 인해 정상세포가 손상되는 것을 막기 위해, 일정 기간만 작동하는데 큰 역할을 한다.
이대호 서울아산병원 종양내과 교수는 “암세포가 항암면역기능을 억제시키는데, 3세대 항암 치료는 면역관문수용체 억제제 또는 상승제를 사용·조절해 환자의 항암면역기능을 회복할 수 있도록 해 효과적인 항암치료를 가능하게 한다”고 설명했다.
이러한 발견은 면역관문억제제 등 면역항암제 개발로 이어졌다. 새롭게 개발된 면역치료제는 다양한 종양에서 치료 효과를 보여 암 치료의 새로운 희망을 제시하고 있다. 기존 치료제 대비 전체 생존기간을 두 배 가까이 늘리는 등 2011년 출시 이후 암 치료의 패러다임을 바꿨다는 평가를 받고 있다.
2010년 면역관문억제제 ‘이필리무밥’의 악성흑색종 환자에 대한 치료 효과가 처음 입증됐고 2012년부터 악성흑색종 뿐만 아니라 폐암에 대한 면역관문억제제 니볼루맙과 펨브롤리주맙 등이 개발에 성공했다. 이 항암제는 이미 국내에서도 허가됐고, 일부 종양에 대해서는 건강보험 급여 적용도 이뤄졌다.
이대호 교수는 “이러한 면역관문 치료제의 장점은 상대적으로 낮은 부작용과 장기간의 효과가 지속돼 완치까지도 바라볼 수 있다는 점”이라며 “물론 모든 환자가 해당약제로부터 효과를 보지는 못합니다만, 이러한 내성기전에 대한 연구도 빠르게 진행되고 있다”고 밝혔다.
이 교수는 “연구자들이 발견한 면역관문수용체와 이에 대한 치료제 개발이 암의 완치 내지는 장기생존을 바라볼 수 있게 했다는 점에서 인류의 건강에 크게 기여했다”고 덧붙였다.

혼조 다스쿠 교수의 노벨상 수상 소식을 듣고 일본 교토대 연구팀이 혼조 교수와 함께 기뻐하고 있다. /트위터 제공
http://dongascience.donga.com/news/view/24183
“새로운 항암치료 시대 열렸다” 노벨상 발표현장 이모저모
2018년 노벨 생리의학상은 면역치료라는 개념을 도입해 암 치료의 새로운 장을 연 제임스 앨리슨(70) 미국 앤더슨 암센터 교수와 혼조 다스쿠(76) 일본 교토대 의대 명예교수에게 돌아갔다. 스웨덴 카롤린스카 의대 노벨위원회는 1일 수상자 발표 직후 이들의 업적과 선정사유를 설명했다. 이어 현지 언론과의 질의응답이 연이어 진행했다.
2018 노벨 생리의학상 수상 발표 후 노벨위원회에서 선정 이유에 대해 밝히고 있다.
다음은 노벨위원회 관계자의 설명.
-“면역시스템은 우리를 보호한다. 면역시스템 안에는 다양한 세포와 분자가 있고, 저마다 서로 다른 기능을 하고 있다. 바이러스나 박테리아의 공격을 받았을 때 면역시스템은 스스로 또는 다른 물질을 통해 자신들의 역할을 한다. 지난 50년 간 혁신적인 연구들을 통해서 면역시스템의 역할이 드러났고, 암세포에 대항하는 면역시스템 연구도 이어졌다. 하지만 효율적인 치료법은 오랫동안 나타나지 않았다. 분명 중요한 부분이 빠져있었다. 오늘 수상한 두 연구자가 그 퍼즐을 끼워 맞추는 역할을 했다.”
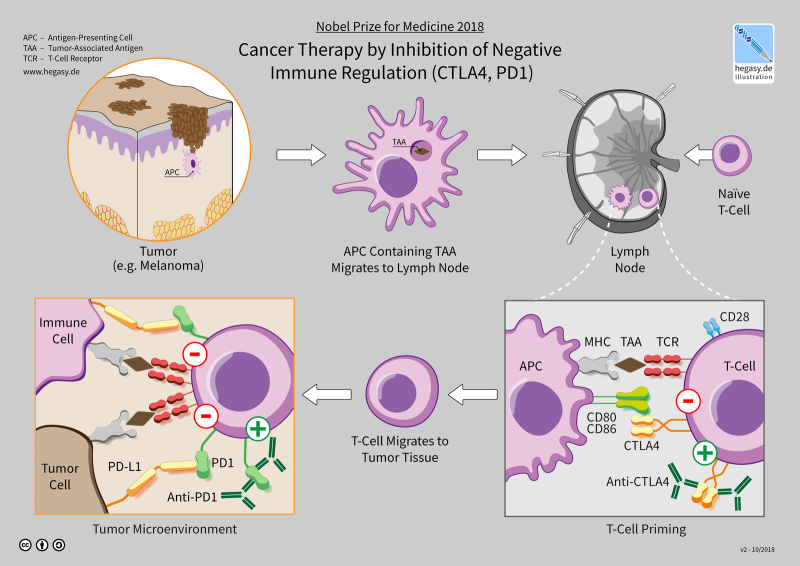
-“1980년대 이후 ‘T세포’에 초점이 맞춰지기 시작했다. 과학자들은 당시 특이한 구조를 인식하는 T세포 수용체를 발견했다. 이 물질은 암세포가 T세포를 연결하는 역할을 한다. T세포는 수용기와 낯선 물질을 인식하면 활동을 하기 시작한다. T세포 표면에 있는 단백질들은 이 활동을 가속하는 역할을 한다. 이 단백질들은 ‘코어 수용기’라고 한다. 이에 연구자들은 이것을 자극하는 연구를 하기에 이른다. 많은 연구자들이 이외에 관련된 분자들이 더 있을 것이라고 생각했고, 일부 다른 분자들은 그 반대 기능을 할 것이라고 생각했다. 그리고 그중 하나가 CTLA-4였다. 이 분자를 깨자 T세포가 멈추는 것이 발견됐다. 앨리슨 교수는 이를 발견한 연구자 중 한 명이다. 이것은 면역세포인 ‘T세포’의 활동을 방해하는 것이었다.”
-“앨리슨 교수팀은 이를 바탕으로 자가면역 연구를 시작했다. 연구팀은 CTLA-4에 대한 항체를 만들었다. 이 항체는 CTLA-4를 파괴했으며, 이는 T세포의 활동을 촉진했다. 그렇게 가설이 세워지자 1994년 크리스마스에 미국 UC버클리에서 실제 실험이 진행됐고, 결국 이 실험으로 인해 면역치료라는 새로운 개념이 탄생했다. 오늘날 쓰이는 면역관문억제제(면역치료제)라는 말은 이때 생겼다.”
-“이 연구 결과는 처음에 그렇게까지 많은 관심을 받은 것은 아니었다. 그러다 작은 생명과학기업이 임상시험용 항체를 개발하는데 도전했다. 몇 년 후, 피부암의 일종인 전이성흑색종 환자14명을 대상으로 실제 임상시험이 진행됐다. (현장에서 사진을 보여주며)이 사진이 환자들의 상태 보여준다. 새로운 치료제는 암을 사라지게 했다. 몇몇 환자에게는 부작용이 나타나기도 했지만 긍정적인 부분이 더 많았다.”
-“2011년 마침내 대규모 임상시험이 승인됐다. 연구진은 많은 수의 환자, 그리고 다양한 암종류를 치료하기 위해서는 추가적인 연구가 필요했 필요했기 때문이다. 그리고, 그와 관련된 연구가 일본에서도 진행되고 있었다.”
-“앨리슨 교수가 연구를 처음 시작하던 때, 일본에선 무슨 일이 있었을까. 1992년 일본 교토대 혼조 타스쿠 교수가 T세포의 표면에서 PD-1이란 단백질을 발견했다. 그는 처음에 이게 무엇을 하는 단백질인지 잘 몰랐다. 혼조 교수는 그 기능을 이해하기 위해 혁신적인 연구를 시작했다. 그리고 7년 간의 연구 끝에 그는 PD-1이 T세포의 기능을 억제하는 역할을 한다는 것을 알게 됐다. 또한 혼조 교수는 PD-1의 한 부분(리간드)이 암세포에 의해서 발현된다는 점을 발견하기도 했다. 이에 따라 PD-1이 암에 대응하는 반응을 촉진하는 것을 알 수 있었다.”
-“혼조 교수는 쥐를 대상으로 한 실험을 거쳐 미국 식품의약국(FDA)에서 승인을 받고 2014년엔 흑색종, 2015년엔 폐암과 신장암을 대상으로 임상시험에 돌입한다. 폐암 환자를 대상으로 한 실험에서 항체 적용 4개월 후부터 치료효과가 나타나기 시작했다. 그러다가 2달 후 종양이 다시 커져 처음 것보다도 더 커지는 증상이 관찰됐는데, 이것은 실제 암 종양이 아니라 암이 치료되며 염증반응에 의한 부종인 것으로 드러났다. 이런 현상은 다른 종류의 암을 대상으로 한 임상시험에서도 자주 나타났다. 기존 연구는 종양을 계속 줄이는 것에만 초점을 맞췄었기 때문에 실험 당시 (이게 진짜 치료가 되는 것인지에 대한) 혼란을 야기하기도 했다.”
-“최종적으로 CTLA-4와 PD-1을 복합적으로 사용한 암 치료 연구가 이뤄졌다. 그 결과, 기존의 치료법은 암 발병 후 2년 이상 지나면 생존율이 10% 아래로 떨어졌지만, CTLA-4와 PD-1을 함께 사용했을 때 치료 3년 후 60% 이상이 생존한 것으로 나타났다. 이 연구로 인해 암 치료는 새로운 단계에 접어들었다.”

수상자를 선정한 노벨위원회에서 현장 취재진의 질문에 대해 답변하고 있다.
아래는 노벨위원회 전문가들과 언론의 일문일답.
-암에 대한 연구가 많은데 왜 이 연구가 노벨상을 받았나.
“기존의 암 연구가 종양 그 자체에만 중점을 두고 연구를 했다면, 이 두 연구는 면역계 전반을 대상으로 하고 있다. 또한 한 종류의 암 종양이 아닌 서로 다른 종류의 암 종양을 타겟으로 하고 있다.”
– 이전 암 연구와 다른 점은 무엇인가?
“암을 치료하기 위한 연구를 크게 두 그룹으로 나눌 수 있다. 기존의 연구는 자극에 의한 치료법이다. 반면 오늘 발표된 연구는 암 종양을 쪼개거나 다른 충격을 가하지 않고, 구조적인 원리를 규명했다. 치료에 대한 효과도 좋았고, 폐암, 신장암 등 여러 종류의 암에 그 효과가 있다.
-이 항암제는 부작용이 없는가?
“몇 가지 부작용이 있었지만, 이는 다시 원상태로 되돌릴 수 있는 부작용이었다. 그리고 부작용보다도 이익이 더 많으며, 현재 있는 부작용을 없애기 위해 지금도 연구 중에 있다.”
-미래 항암치료 방향은?
“여태까지의 연구들을 복합하는 것, 그리고 이것들을 이용해 환자 개개인에 맞게 맞춤치료를 하는 방향으로 나아갈 것으로 보인다.”
-수상자들의 소감을 듣고싶은데.
“앨리슨 교수는 연결이 되지 않았다. 혼조 교수는 전화로 ‘매우 기쁘다’고 전해왔다.”
http://m.medigatenews.com/news/2451113259
올해 노벨생리의학상은 누가 받을까?
면역항암제 개척자 제임스 앨리슨 박사 기대
해마다 10월이면 노벨상을 주관하는 스웨덴 왕립과학아카데미와 노르웨이 노벨위원회가 노벨상 수상자를 발표한다.
2017년 올해 노벨 생리의학상은 누가 받을까? 이제 7월이지만 빨리 시원한 가을이 왔으면 하는 바람에서 미리 생각해 보았는데, 아무래도 현재 엠디 앤더슨(MD Anderson) 암센터에서 면역학 부분을 이끄는 제임스 앨리슨 (James Allison) 박사가 받지 않을까 예상한다. 앨리슨 박사는 “면역계의 핵심적인 분자 브레이크 시스템을 억제함으로써, 면역계의 암 살상능력을 증강시킬 수 있다”는 사실을 25년에 걸쳐 입증해 왔다.
해당 분야에 있어서의 획기적인 과학적 발견과 그 발견의 사회적 공헌도를 살펴보는 것 외에 이렇게 노벨상 수상을 점칠 수 있는 것 중에 하나는 레스커상의 수상 유무이다.
성공한 광고기업인이자 자선사업가로 건강·의료 연구 증진에 관심이 많았던 앨버트 래스커와 그의 아내 메리 래스커가 설립한 이 상은 ‘미국의 노벨상’으로 불리기도 하는데, 1945년부터 한 해에 한 차례 의학 분야에 큰 기여를 한 이에게(현재 생존자에 한해) 수여하는 상이다. 지금까지 86명의 래스커 수상자들이 노벨상을 받았으며, 이 중 32명은 지난 20년 내에 수상하였다.
제임스 앨리슨 박사는 2015년 래스커상(임상의학 연구부문)을 수상하였는데, 면역 항암제라는 새로운 영역을 개척하여 암환자에 대한 치료 효과를 향상시킨 공로를 인정받았기 때문이다.
전통적인 암 치료법은 약물을 이용하여 암을 초래한 돌연변이를 공격하는 것이다. 이는 좋은 방법이기는 하지만, 종양이 약물에 대해 저항성을 갖게 되는 등의 문제점을 가지고 있다. 면역요법, 특히 면역관문 억제요법(checkpoint blockade therapy)은 몇 가지 점에서 전통적 암치료법과 다르다.
첫째, 면역요법은 면역계로 하여금 암을 공격하게 하며, 특히 면역관문 억제요법은 T세포로 하여금 종양을 공격하게 한다. T세포는 세포 표면에서 돌연변이나 외부에서 유입된 펩타이드를 탐지하는데, 면역관문 억제요법으로 치료받은 T세포는 새로운 돌연변이를 인식하게 된다.
둘째, 적응성(adaptability)이다. 인간의 면역계는 동적 시스템이므로, 종양이 변화할 경우 면역계도 따라서 변화한다. 종양이 공격을 받아 죽을 때 또 다른 항원을 만들어내지만 T세포와 B세포는 새로운 항원을 공격할 수 있는 세포군들을 더 만들어내는 적응력을 발휘한다.
화학요법이나 방사선요법과 비교하여 세 번째 차이점은 T세포는 자체의 “기억(memory)” 기능이다. 특별히 암세포에서 유래되거나 변형된 돌연변이를 T세포를 통해 기억을 계속 보유하므로, 향후에 종양이 다시 발생할 때 기억을 유지하고 있는 T세포를 동원하여 종양을 공격하게 된다.
사실, ‘면역계를 이용하여 암을 치료할 수 있다’는 이론을 처음 제기한 인물은 폴 에를리히(Paul Ehrlich)이다. 1909년 에를리히는 “면역계가 항체를 보유하고 있어서, 종양을 제거할 수 있다”고 생각했다. 그러나 ‘어떤 항체를 이용할 것인가?’가 문제였다.
앨리슨 박사는 1990년대 중반부터 25년 동안 거의 ‘CTLA-4’라는 단백질, 즉 ‘T 세포에 있는 항원4’을 중점적으로 연구하였다. 이 단백질은 T세포의 활성의 강약을 조절하는 역할을 한다. 앨리슨은 ‘CTLA-4’에 브레이크를 거는 ‘Anti-CTLA-4’ 단클론항체를 만들어 활성을 차단함으로써, T세포의 암 살상력을 증강시키는 방법을 발견하였다.
그는 이 새로운 암 치료법을 개발하는 데 혁혁한 공을 세웠고, 2011년 여보이(Yervoy)가 면역 항암제로 FDA의 승인 허가를 받았다. 특히 평균 기대수명이 1년 미만인 전이성 흑색종을 여보이로 치료한 경우 환자의 수명을 무려 10년이나 연장시키는 것을 입증한 바 있다.
여보이를 시작으로 하여 2014년 후반 거의 동시에 허가를 받은 PD-1 억제제, 키트루다(Keytruda)와 옵티보(Opdivo), 2016년 허가를 받은 PD-L1을 억제하는 티센트릭(Tecentriq) 등 면역관문 억제제들은, 암환자의 삶의 질을 눈에 띄게 개선시킨다. 그러므로 면역 항암제의 경제적 가치는 비싼 비용을 훨씬 상회하며 화학요법에 비할 바가 아니다.
면역 항암제가 아직 모든 환자를 치료할 수는 없지만, 다른 치료법보다 훨씬 더 효과적이라는 것만은 분명하다. 많은 임상을 통하여 면역 반응을 강화시켜 암을 치료할 수 있음을 입증하였고 다른 항암제와 병용 투여를 통하여 면역 항암제의 효용성이 증명되고 있는 것은 매우 고무적이다.
면역 항암제와 기존 항암 치료제의 병용 투여 방법으로 조만간 대다수의 암을 치료할 수 있으리라 생각한다. 이러한 이유로, 면역 항암제의 개척자인 제임스 앨리슨 박사가 이번 가을에 노벨상을 받을 것이라고 예상하는 것은 그리 어려운 일이 아니다.
http://m.kpanews.co.kr/article/show.asp?table=column_youth&idx=458
암치료의 패러다임을 바꾼 3세대 암 치료제- 면역항암제
최근 암 치료에 있어 가장 핫한 이슈인 ‘면역항암제(immune checkpoint inhibitor)’에 대해 알아보고자 한다.
면역항암제란 간단히 말해 우리가 가지고 있는 고유의 면역계를 강화시켜 암과 싸우는 힘을 길러주는 약물이다. 우리가 가진 본연의 힘으로 암을 저지한다는 점에서 지금까지의 암치료를 바라보는 개념과 근본적인 차이가 있다.
본래 암세포는 T세포의 ‘PD-1’, ‘PD-L1’, ‘CTLA-4’ 등의 면역 체크포인트 단백질(면역관문)과 결합함으로써 면역 회피 신호를 보내어 T세포의 암세포 공격을 회피한다.
면역항암제는 암세포와 T세포의 결합 부위에 결합하여 면역회피 신호를 차단함으로써 면역학적 시냅스가 형성되지 못하고, 이에 따라 면역회피 방해를 받지 않는 T세포가 암세포를 파괴하는 메커니즘을 통해 암을 치료한다.

T세포는 암세포에서 발현하는 항원을 확인해 암세포를 공략할 수 있는데 이것이 제대로 활동할 수 있도록 함으로써 지속적인 항암효과를 꾀한 것이다.
덕분에 면역항암제는 끊임없는 암세포의 변화에도 불구하고 지속적인 항암효과를 나타내어 암 치료 효과를 높일 수 있을 것으로 기대된다.
면역항암제는 기존의 암 치료법의 단점을 보완하였다. 1세대 화학항암제는 암세포를 직접 공격하고, 2세대 표적 항암제는 암 관련 유전자를 공격하는 기능을 한다면 3세대 항암제라 불리는 면역항암제는 면역력을 강화해 암을 치료하게 된다.
방사선 요법이나 항암제 등 직접적으로 암세포를 공격하는 기존 치료법이나 약물과 달리 환자의 면역력 강화를 통해 암을 치료하기 때문에 면역항암제는 항암부작용을 최소화하고 면역력을 높일 수 있는 치료법으로 주목받고 있다.
기존의 화학 항암치료법은 암 세포를 사멸하기 위해 정상세포까지 무차별하게 공격하여 환자의 면역체계를 무너트리고 항암 치료제의 강한 독성으로 인해 탈모, 구토, 식욕저하, 피로감, 극심한 체력저하 등 각종 부작용이 있었다.
면역항암제는 환자 스스로의 면역강화를 통해 치료를 한다는 점에서 이러한 부작용이 적고 암 환자의 삶의 질을 높이고 생존기간도 대폭 연장되는 효과가 있다.
또한 표적항암제는 암 세포만을 식별해 공격하는 능력이 있어 임상 현장에서 각광 받았지만, 적용할 수 있는 암의 종류가 한정적이고 내성이 생기는 경향이 있어 일반적으로 활용되기 어려웠다.

면역항암제는 면역세포가 가진 암세포 식별 능력을 활용하므로 암의 종류에 크게 구애받지 않고 변화무쌍함 암세포에 맞춰 스스로 무기를 바꿀 수 있는 면역세포들을 활용함으로써 보다 효율적으로 암세포에 대항할 수 있다는 장점이 있다.
그러나 면역항암제의 특정 타겟을 목표로하는 것이 아니라 면역체계가 스스로 암세포를 공격하도록 조력하는 특성으로 인해 뇌암처럼 항체의 접근이 어려운 암종에서의 효과는 불확실하다는 한계가 있다.
이외에도 새로운 기전의 치료제다 보니 기존 치료제의 평가방법을 적용하기에도 고민이 크다. 면역세포가 암세포를 공격하기 위해 결합하는 과정에서 종양의 크기가 일시적으로 커지기는데 종양의 크기를 기준으로 한 현재의 항암 치료 평가방법은 면역항암제의 치료 효과를 확인하는데 상당히 불리하기 때문이다.
이는 대조군과의 임상설계, 적응증의 허가, 급여기준을 획득하는 데에도 불리하게 작용할 것이다.
뿐만 아니라 면역기능에 작용하는 만큼 반대로 면역기능을 낮춰야 하는 면역질환이 동반된 경우, 또는 간염과 같은 감염성 질환을 가지고 있는 경우 면역항암제의 사용은 쉽지 않다.
제약회사는 이제 막, 하나 둘 그 모습을 보이기 시작한 면역항암제들이 그 한계를 극복하고 항암 치료의 새로운 지표를 열 수 있도록 뜨거운 관심과 연구를 쏟고 있다.
국내에서는 PD-1 계열 면역항암제로 키트루다와 옵디보를 출시하였다. 키트루다는 2016년 5월 흑색종, 비소세포폐암 치료제로 국내 승인을 받았고 옵디보는 세계 최초로 PD-1 면역항암제 승인을 받았다.
그밖에도 로슈의 테센트릭이 PD-1 계열 면역항암치료제로서 지난달 5월 미국 식품의약국에서 최초로 방광암 치료제로 발매 허가를 받았다.
인간의 평균 수명이 계속 늘어남에 따라 암 환자가 늘고 고령화되면서 세계 항암 치료제 시장이 지속적으로 성장할 것으로 예상된다.
세계 면역항암제 시장 규모는 2015년 16억 달러에서 오는 2020년 350억달러로 증가할 것으로 예상되고 2022년에는 항암제 분야가 1900억 달러의 시장 규모를 가지며 연평균 12.5%의 성장률을 보일 것으로 전망된다.
http://www.monews.co.kr/news/articleView.html?idxno=84804
면역항암치료, 분자생물학으로 날개
면역시스템을 조절해 암을 치료하는 접근방식은 생각보다 오랜 전부터 시도돼 왔다.
1891년 뉴욕의 외과의사였던 윌리엄 콜리(William B. Coley)가 수술이 불가능한 암환자에게 용혈성 연쇄상구균을 주입함으로써 악성종양의 축소반응을 유도한 것이 시초라고 여겨진다. 1967년에는 오스트레일리아의 면역학자인 프랭크 버넷(Frank M. Burnet) 박사가 정상적인 면역반응으로 암세포에 대응할 수 있다는 면역감시가설(immune surveillance theory)을 제시하며 힘을 실었다.
1980년대부터 인터페론·IL-2에 관심
 |
||
면역항암요법의 임상연구가 활기를 띠게 된 것은 1980년대 중반 이후다.
미국립암연구소(NCI)의 스티븐 로젠버그(Steven A. Rosenberg) 박사팀은 표준치료에 실패한 전이암 환자 25명에게 재조합 인터루킨-2(IL-2)와 환자 본인의 면역세포(Lymphokine-Activated Killer cell, LAK)를 투여한 결과를 NEJM 1985;313:1485-92에 공개했다.
논문에 따르면 면역치료를 받았던 25명 중 11명에서 종양의 크기가 50% 이상 감소했고, 전이성 흑색종으로 진단받았던 1명은 암세포가 완전히 사라졌으며(CR), 그 효과가 10개월이 넘는 기간 동안 지속됐다.
앞선 동물실험을 통해 막연하게나마 암의 진행과정에 면역체계가 관여한다는 가설이 알려졌지만 환자의 면역세포를 다시 주입함으로써 면역기능을 조절하고, 항암효과를 유도할 수 있다는 가능성이 임상단계에서 제시된 것은 처음 있는 일.
가톨릭의대 강진형 교수(서울성모병원 종양내과)는 “당시만 해도 T세포, B세포에 대한 개념이 정립되지 않았을 때였는데, 신장암 환자의 T세포를 빼내 림포카인이라는 물질로 활성화시킨 뒤 다시 주입했더니 폐전이 병소가 줄었다. 암환자들에게 면역치료의 가능성을 처음으로 제시한 의미 있는 연구”라고 평가했다.
관련 연구가 지속되면서 신장암보다도 흑색종이 면역기전이 중요한 암으로 주목을 받기 시작한다.
2000년대 들어 영국 글래스고대학 로나 마키(Rona M. MacKie) 교수는 신장이식 후 흑색종이 발생한 사례를 보고했다(NEJM 2003;348:567-568).
해당 환자에게 신장을 이식해준 기증자는 16년 전 흑색종을 앓다 제거수술을 받고 완치된 병력이 있었다. 흥미롭게도 기증자에게는 흑색종 재발 소견이 전혀 없었지만 수혜자는 면역억제제를 복용하는 과정에서 흑색종이 발현돼 결국 사망하고 말았다.
면역반응으로 암을 조절할 수 있다는 데서 한걸음 더 나아가 면역체계가 제대로 작동하지 않을 경우 암이 재발할 수 있다는 사실까지 확인하게 된 셈이다.
이후 흑색종 환자들을 대상으로 인터페론, IL-2 같은 활성물질을 주입하고 림프구를 활성화시키는 임상연구가 10여 년 넘게 시도돼 왔다.
문제는 일단 면역치료의 효과가 나타나면 반응이 오래 지속되지만 어떤 환자들은 반응하지 않고, 어떤 환자에서 잘 반응하는지조차 알 수 없다는 것.
근래에는 흑색종 환자의 혈액으로부터 수지상세포(dendritic cell)를 분리해 체외에서 활성화시킨 뒤 다시 넣어주는 방식의 연구도 소규모로 진행 중이다.
이필리무맙·니볼루맙 ‘종횡무진’…흑색종 외 다른 암종도 연구 줄이어
임상에서 면역항암제 도입이 본격화 된 데는 이필리무맙(ipilimumab)이라는 신약의 등장이 결정적 계기가 됐다.
 |
||
BMS가 개발한 항CTLA-4 단일클론항체 이필리무맙은 별다른 치료수단이 없었던 전이성 흑색종 환자의 생존율을 유의하게 증가시킴으로써(NEJM 2010;363:711-23) 세계 최초로 미국식품의약국(FDA)의 승인을 받았다.
CTLA-4는 T세포와 암세포 사이의 후기 면역반응에 관여, T세포 활성을 저해시키는 물질이다. 이를 차단하면 T세포의 활성 및 증식이 증가돼 항암 효과를 나타낸다는 게 이필리무맙의 기본 원리다.
수술이 불가능하거나 전이성인 흑색종 환자를 대상으로 진행됐던 3상임상에서 이필리무맙 3mg/kg 단독요법은 glycoprotein 100 단독요법 대비 사망 위험을 34% 감소시켰다(HR 0.66, 95% CI: 0.51-0.87; P=0.003). 일부 환자의 경우 종양반응기간(ORR)이 44개월을 넘었다.
지난해에는 이필리무맙이 악성 흑색종의 재발을 막는 데도 효과적이라는 연구 결과가 미국임상종양학회 연례학술대회(ASCO 2014)에서 발표됐다.
3기 흑색종 환자 951명을 3년간 추적한 결과에 따르면 이필리무맙군의 무재발생존율(RFS)이 46.5%로 위약군(34.8%)에 비해 11.7% 높았다.
또한 수술이 불가능한 전이성 흑색종 환자 1800여 명에 대한 통합분석(J Clin Oncol 2015;33:1889-94)에서는 이필리무맙 투여 후 약 3년째부터 안정적인 생존곡선이 유지됨을 알 수 있었다. 이때 생존율은 과거 치료 여부와 관계 없이 20%대를 유지했으며, 일부 환자는 10년까지도 생존했다.
현재 이필리무맙은 니볼루맙(nivolumab) 같은 다른 면역항암제와의 병용요법(NEJM 2015;372:2006-2017)을 비롯, 흑색종이 아닌 다른 암종에 대해서도 임상연구가 활발하게 진행되고 있다.
PD-1·PD-L1 억제제 계열 면역항암제 승인 잇따라
PD-1, PD-L1과 같이 면역작용에 관여하는 또 다른 타깃분자의 발굴은 새로운 면역항암제의 개발로 이어졌다.
세계 최초의 PD-1 표적면역항암제 니볼루맙은 PD-1과 결합한 뒤 PD-L1 및 PD-L2와의 상호작용을 차단함으로써 T세포를 재활성화시키는 기전으로 원리는 CTLA-4 억제제와 다르지 않다.
지난해 말 미국에서 승인된 니볼루맙은 수술이 불가능한 전이성 흑색종 가운데 이필리무맙에 반응하지 않는 환자에게 투여했을 때 기존 항암화학요법 대비 뛰어난 종양반응률(Lancet Oncol 2015;16:375-84)을 선보였다. BRAF 유전자의 V600E 돌연변이가 확인된 경우라면 BRAF 억제제와 이필리무맙 병용 후 질병진행을 보인 전이성 흑색종 환자에게도 투여할 수 있다.
최근에는 흑색종은 물론 폐암에서도 종횡무진 적응증을 넓혀가는 모습이다.
지난 3월에는 백금기반 항암화학요법을 받았던 진행성 편평상피 비소세포폐암(NSCLC) 환자에서 도세탁셀 대비 전체 생존기간(OS)을 3.2개월 연장시켰다는 임상 근거에 따라 FDA 우선심사 대상으로 선정, 본래 예정일보다 3개월가량 앞당겨 확대승인 됐다.
또한 미국임상종양학회(ASCO 2015) 기간 중에는 타이로신키나제억제제(TKI)와 백금화학요법 이후 재발한 비편평상피 비소세포폐암 환자의 사망률을 도세탁셀군(OS, 12.2개월 vs. 9.4개월) 대비 27% 감소시켰다는 Checkmate 057 연구로 주목을 받았다.
초기 임상이었지만 진행성 간세포암(HCC) 환자에게 니볼루맙을 투여했을 때 6개월 째 전체생존율(OS)이 72%, 12개월 째 62%로 소라페닙의 평균 생존율(약 30%)을 훌쩍 뛰어넘었다는 흥미로운 데이터도 있다(ASCO 2015 #Abstract LBA101).
당시 전체 41명 중 2명(5%)이 완전반응(CR)을, 7명(18%)이 부분반응(PR)을 보였고 각각에서 반응지속기간은 14~17개월, 1~8개월이었다. 연구 참여군 중 절반가량(20명)이 안정병변(SD)을 유지했으며, 이러한 상태가 최대 17개월까지 지속됐다는 보고다.
‘면역표적’ 개념 도입…분자 수준에서 면역조절
가톨릭의대 강진형 교수는 “면역항암제가 두경부암, 폐암, 흑색종, 신장암 등 기존 항암제에 반응하지 않았던 다양한 암종에 효과를 나타낸다”면서 “인터페론, IL-2를 이용한 면역치료와 마찬가지로 일단 반응이 있는 환자는 지속기간이 상당히 길다”고 말했다.
다만 면역체계 내의 표적을 알고 있다는 게 분명한 차이.
과거의 면역치료가 불특정한 면역세포를 자극시키는 방식에 머물렀다면 암과 면역계 사이의 조절기전이 밝혀진 지금은 세포 내 분자 수준에서 특정 물질을 차단하고 면역세포의 활성을 유도하는 면역표적항암제로 진일보 한 셈이다.
차세대염기서열분석(NGS) 기술의 발달로 암종별 유전자 변이의 빈도(frequency)도 확인할 수 있게 됐다. 강 교수는 “흑색종이나 편평상피 비소세포폐암, 두경부암 같이 변이 빈도 또는 유전자 변이 부담(mutation burden)이 높은 암종일수록 면역항암제에 잘 듣는다”고 소개했다.
유전자 변이가 많으면 세포가 제 기능을 하지 못해 세포질이나 세포표면 내에 비정상적(abberant) 단백질을 많이 만들어내는데, 이들이 항원성(antigenecity)을 가지므로 T세포, 수지상세포 등 면역반응의 관여가 활발해진다는 것.
이때 암세포가 면역회피 기전으로서 T세포를 차단하기 위해 세포 표면에 만들어내는 CTLA-4, PD-1 등의 물질들(inhibitory immune checkpoint molecule)이 오늘날 면역항암제의 타깃이다.
면역치료제 개발동향 – 2017년 1월 현재
• 최근의 암 치료는 기존에 각광을 받던 표적항암치료에서 면역치료제로 ‘패러다임 시프트’가 이루어지고 있으며, 최근 3~4년 사이 면역요법의 암 치료는 한 단계 더 진보하며 효과를 입증하는 물질들이 개발됨
– 2010년도부터 FDA의 승인을 받은 면역치료제가 현재까지 7건이 승인되는 등 면역항암요법의 적용이 본격화되고 있음

• 암 면역치료제는 면역시스템을 자극하여 암을 치료하는 분야이며, 인체의 면역시스템 이용 방법에 따라 능동적/수동적 면역치료로 구분 할 수 있음
(수동적 면역치료) 체외에서 다량으로 만들어진 면역반응 성분(면역세포, 항체, 사이토카인 등)을 암환자에게 주입하여 암세포를 공격하는 치료방법
(능동적 면역치료) 개인의 항체와 면역세포들을 능동적으로 활성화 또는 생산시키게끔 하여 암세포를 공격하는 치료방법

• IMS Institute에 따르면 전세계적으로 암 면역치료제에 대해 활발히 연구 중이며, PD-1 inhibitor, CDK inhibitor, Anti-CTLA-4 antibody, CAR T-cell therapy, ALK inhibitor 등 다양한 유형의 암면역치료제 개발을 위한 연구가 주로 진행 중
– 암 면역치료제로서 PD-1, PD-L1이 가장 활발하게 연구되고 있으며, PD-1은 기 허가받은 약물로 적응증 확대를 위한 추가 임상연구 및 신규 약물 개발 연구가 이루어지고 있으며, PD-L1은 아직까지 FDA 승인을 받은 약물은 없으나 최근 PD-1과 함께 집중적인 연구가 이루어지고 있음
– CAR-T 세포치료제는 차세대 개인맞춤 의료 신약으로 부상하고 있고 혈액암 치료에 처음 적용될 수 있을 것으로 전망되며, 2020년대에는 상용화 될 것으로 전망
– 면역치료제 개발 시 CTLA4와 PD-1, PD-L1 이외에도 OX40, LAG-3, STING 등의 연구가 활발히 이루어질 예정이며, 그 외에도 NK cell과 대식세포(macrophage)를 타겟으로 디자인된 agents가 개발될 것으로 전망됨

• 최근 면역치료제 개발에서의 가장 중심적인 키워드는 T세포이며, T세포 활성화를 통한 항암제 개발은 크게 T세포를 직접 자극하는 방식과 다른 면역세포들을 자극하는 간접적인 방식으로 분류할 수 있음
– T세포를 직접 자극하는 방식은 다국적제약사들의 개발이 집중되고 있는 PD-1, CTLA-4, LAG-3, TIM-3 등의 면역체크포인트를 억제(Immune checkpoint modulator)하는 방식과 또는 OX40, CD137, CD27, CD40 등 보조활성인자를 자극하는 방식임
– T세포를 간접 자극하는 방식은 Treg, MDSC, TAM, IDO 등 체내 면역기능 억제를 유발하는 인자들을 억제하거나 화학요법 및 방사선요법을 통해 면역반응을 자극하는 방식임

• 면역치료제 중 가장 활발한 연구가 이루어지고 있는 면역체크포인트저해제인 Anti-PD-1/PD-L1의 경우, 2014년 기준 후기 개발단계의 블록버스터 파이프라인 현황에서 상위 1~3위를 차지하여 면역항암제 중에서도 가장 빠르게 상업적 성과를 가져올 것으로 예상됨
이 중 PD-1 억제제인 Nivolumab은 2015년 폐암, 신장암에 대해 FDA 승인을 획득

• 면역항암제 단독요법 개발 뿐 아니라 병용요법도 화두가 되고 있으며, 다양한 면역조절 경로 또는 면역조절자들을 자극 및 억제하는 방향으로 면역항암제 개발이 이루어지면서 병용치료가 면역항암요법 개발의 기본 전략이 되고 있음
– 면역치료제와의 병용치료를 실시할 경우 암 환자의 전체 생존기관을 증대시키고 치료적 반응의 지속성을 유지할 수 있을 것으로 전망
– 면역치료법과 타 치료법의 병용뿐 아니라, 면역치료 내에서도 단일클론항체, 사이토카인, 백신 등에서 기대할 수 있는 기대효과가 각기 상이한 바 다양한 접근을 동시에 활용함으로써 항암 효과를 극대화할 수 있을 것으로 전망됨
– 항암 면역치료의 병용요법에서도 가장 중심적인 키워드는 T세포이며, 병용요법의 목표는 T세포를 암세포에 근접하게 유도하기 위한 전략(TILs)과 종양세포에 근접했어도 탈진한 T세포를 활성화시키는 전략 등을 활용하여 현재까지 밝혀진 치료효과를 더욱 향상시키고자 함
-특히 T세포 활성화 전략의 하나로 면역체크포인트 억제제를 중심으로 한 병용치료요법의 임상시험이 전세계적으로 다양하게 진행되고 있음

PD-1·PD-L1 계열, 적응증 추가·병용연구 활발
끊임없는 진화…거의 모든 고형암에 도전장
국내외에서 허가된 면역항암제는 2~3개에 불과하지만 개발되는 약물이 많아 향후 2~3년 안이면 사용할 수 있는 약물이 더 늘어날 전망이다. 종류는 겨냥하는 세포에 따라 면역세포에 작용하는 PD-1과 종양세포에 작용하는 PD-L1 계열로 구분된다.
PD-1 계열
PD-1을 겨냥하는 약물로는 니볼루맙, 펨브롤리주맙, AMP-224, AMP-554, 피딜리주맙(pidilizumab, CT-011) 등이 있다. 특히 니볼루맙, 펨브롤리주맙은 이미 국내에서도 허가를 받은 약물로 기본 적응증 외 적응증 확대를 위한 추가 임상이 진행 중이다.
▶ 니볼루맙
니볼루맙(nivolumab)은 일본 오노제약이 개발한 제품으로, 지난 3월 옵디보라는 제품명으로 식품의약품안전처의 승인을 받았다. 국내 허가를 획득한 흑색종 적응증 외에도 비소세포폐암, 전립선암, 신세포암, 간암 등 거의 모든 고형암에 대해 단독요법 연구가 진행 중이다. 또한 반응률을 조금 더 끌어올리기 위해 다양한 약물 병용효과를 검증하고 있다.
진행성 고형암에 대해서는 항KIR 제제인 일리오룸바(iliolumbar)와 병용하는 연구가 진행되고 있으며, 위암, 췌장암, 소세포암 분야에서는 CTLA-4 면역관문억제제인 이필리무맙(ipilimumab)과 병용한 연구가 한창이다. 아울러 교모세포종에 대해서도 니볼루맙과 이필리무맙의 연구가 진행 중인데, 이를 베바시주맙(bevacizumab)과 비교한다.
비소세포폐암은 니볼루맙의 차기 적응증이 있는 만큼 연구가 활발하다. 기존의 젬시타빈/시스플라틴(gemcitabine/cisplatin)과 같은 화학요법과 병용은 기본이고, 퍼메트렉시드/시스플라틴(pemetrexed/cisplatin), 카보를라틴/파클리탁셀(carboplatin/paclitaxel), 베바시주맙(bevacizumab), 엘로티닙(erlotinib), 이필리무맙(ipilimumab) 등 다양한 조합의 연구가 진행 중이어서 과연 어떤 조합과 병용할 때 가장 높은 반응률을 얻을 수 있는지가 향후 중요한 관심사로 떠오를 전망이다.
아울러 아직 이렇다 할 치료제가 없는 신세포암 분야에서도 니볼루맙과 수니티닙(sunitinib), 파조파닙(pazopanib), 이필리무맙과 병용하는 연구가 추진되고 있다.
올해 미국임상종양학회(ASCO)에서 주목을 받았던 연구는 간암에서의 니볼루맙의 효과이다. 1/2상 연구(Abstract LBA101)가 나온 것인데 환자들의 객관적 반응률은 19%였고 예비 1년 전체 생존율이 62%로 나타나면서 간암분야의 신약탄생을 예고했다.
▶ 펨브롤리주맙
지난 2월 국내에서 키트루다로 허가된 펨브롤리주맙(pembrolizumab)은 미국 머크사가 개발한 약물이다. 머크사는 이 약물로 국내 항암제 시장에 출사표를 던졌다. 펨브롤리주맙은 머크사가 보유한 유일한 항암제인데 한 가지 약물로 국내 항암제 시장에 도전장을 던진 것은 이 약물의 무한한 가능성 때문이다.
현재는 흑색종에만 효과가 입증됐지만 니볼루맙처럼 거의 모든 암종에서의 적응증을 획득하는 것을 목표로 연구가 활발하다.
특히 니볼루맙과 달리 위암, 두경부암, 삼중음성 유방암 등 아직 마땅한 치료제가 없는 암종에 대해 효과를 검증해 틈새시장을 노리겠다는 전략이다. 대부분 1상임상을 통해 가능성을 확인했다.
아울러 비소세포폐암 환자들을 대상으로 도세탁셀과 비교하는 연구가, 신세포암 환자들에게는 파조파닙과 병용하는 연구가 진행 중이다.
올해 ASCO에서 주목을 받았던 연구는 직결장암 환자들을 대상으로 펨브롤리주맙의 2상임상 효과가 나온 것인데 mis-match repair 결손이 있는 경우 더 효과가 뛰어난 것으로 나와 면역항암제의 효과를 알 수 있는 바이오마커를 찾았다는 평가도 받고 있다.
 |
||
| ▲ 연구가 진행중인 PD-1 계열 면역항암제 | ||
▶ AMP-224, AMP-514
AMP로 시작하는 제품은 아스트라제네카 그룹의 자회사인 엠플이뮨(Amplimmune)이 개발하고 있는 약물이다. AMP-224은 PD-1과 B7-H1을 상호 작용을 차단하는 퓨전 프로테인(fusion protein)으로 현재 글락소 스미스클라인과 공동 개발하고 있다. 여러 가지 암과 만성 감염질환에 대해 효과를 확인했고, 현재 1상임상 단계다. 아울러 PD-1 계열의 약물로 AMP-514도 개발 중인데, 현재 독성연구가 진행되고 있다.
▶ 피딜리주맙
피딜리주맙은 큐어텍사가 개발한 PD-1 계열의 면역항암제다.
백혈병, 흑색종, 폐암, 유방암, 직장암, 등에서 가능성을 확인하고 연구가 한창이다. 1상임상에서 혈액암 환자에 대한 효과를 확인했고, 2상임상도 완료하면서 혈액암에서의 면역억제제 치료 가능성을 열였다.
2상임상에서 자가유래 줄기세포를 이식한 큰 B-세포 림프종(diffuse large B-cell lymphoma) 환자의 무진행 생존율은 72%였으며, 전체 생존율은 82%이다. 그 외에 전이성 직결장암 환자와 전이성 흑색종 환자에 대한 2상임상 모집이 완료됐으며, 추가로 진행되는 혈액암과 고형암에 대한 연구가 추진되고 있다.
PD-L1 계열
PD-L1 계열에서는 BMS-936559, MEDI4736, MPDL3280A, MSB0010718C 등이 개발되고 있다.
▶ BMS-936559
BMS-936559는 브리스톨마이어스퀴브사(BMS)가 개발 중인 약물로, PD-L1이 PD-1과 CD80에 결합하는 기전을 갖고 있다.
현재 진행성 암 환자를 대상으로 한 가능성을 입증한 상태다. 지난 2012년 ASCO 발표와 동시에 NEJM에 BMS-936559의 결과가 실린 바 있는데, 흑색종 환자의 객관적 반응률(ORR)은 17%, 신장암에서는 12%였다. 또 비소세포폐암에서는 10%였으며, 난소암에서는 6%를 보이고 있다. 현재 1상임상이 완료됐다.
▶ MEDI4736
MEDI4736은 아스트라제네카가 개발 중인 PD-L1 계열의 면역항암제로 다양한 고형암종에서 효과를 확인했다. 이를 통해 지난해 5월부터 비소세포폐암환자(NSCLC)를 대상으로 3상을 시작했다. 연구명은 PACIFIC으로 방사선 치료를 한 절제불가능, 전이된 환자를 대상으로 위약과 비교하게 된다. 아스트라제네카가 개발하는 면역항암제의 첫 3상연구이기도 하다.
▶ MPDL3280A
MPDL3280A는 로슈그룹의 바이오제약사인 제넨텍이 개발한 작품이다. 흑색종, 비소세포폐암, 신장암, 고형암 등 다양한 연구가 진행되고 있으며 결과도 좋아 향후 면역항암제의 강자로 평가받고 있다.
지금까지 나온 객관적반응률은 원격 전이 및 진행성 고형암에서 21%를 보이고 있다. 세부적으로 비소세포폐암 코호트 환자에서는 23%, 전이성 흑색종 코호트 환자에서는 26%로 나온 바 있다.
로슈는 올해 ASCO에서 비소세포폐암환자를 대상으로 한 2상 연구인 POPLAR 연구 결과를 발표했는데 여기서 도세탁셀과 비교해 전체 생존율을 53%가량 개선시킨 것으로 나오면서 폐암치료를 이끌 차세대 면역항암제로서의 면모를 과시했다.
이 외에도 신장암에서도 베바시주맙과 병용했을 때 수니티닙과 비교하는 연구가 진행 중이며, 그 밖에 다양한 고형암에서도 기존 약제들과 병용했을 때 얼마나 효과가 높은지를 평가하고 있다. 현재 3개의 2상임상과 6개의 3상임상이 순항 중이다.
한편 올해 2월 FDA로부터 혁신적 치료제로 지정받았다.
 |
||
| ▲ 연구가 진행중인 PD-L1 계열 면역항암제 | ||
▶ MSB0010718C(아벨루맙)
MSB0010718C는 머크세로노가 야심차게 개발 중인 면역항암제다. 종양세포 표면의 PD-L1를 종양 내부로 침투할 수 있는 면역세포가 탑재된 PD-1과 결합시킴으로써 면역억제 신호전달 과정에서의 교란을 유도할 수 있을 뿐만 아니라 ADCC(Antibody-Dependent Cellular Cytotoxicity: 항체 의존성 세포독성 작용)를 유발하도록 설계돼 있다.
올해 ASCO에서는 MSB0010718C의 진면목을 보여줬다고 해도 과언이 아닐 정도로 많은 연구가 쏟아졌다. 모두 10건의 연구가 소개됐다.
대부분 1상임상의 초기연구가 발표됐는데 전이성 메르켈 세포암 환자를 대상으로 한 2상임상도 포함돼 있다.
초기 임상이지만 진행성 혹은 전이성 고형암(비소세포폐암, 위암, 난소암, 유방암, 악성 흑색종 등) 환자를 대상으로 안전성과 및 내성평가를 입증했고, 특히 일본 위암 및 진행성 고형암 환자를 대상으로 한 연구를 통해 아시아 환자에서의 가능성도 확인한 바 있다.
백금기반 항암화학요법 이후 암이 진행된 비소세포폐암 환자를 대상으로 한 1상임상도 나왔고, 항암 치료 이후 재발성 혹은 난치성 난소암 환자에서 실시한 1상임상도 나오면서 다양한 암종에서의 적응증 확대를 예상하고 있다.
면역항암제 부스터
면역항암제의 효과를 증강하는 부스터 약제도 있다. 화이자제약이 개발하는 PF-05082566이 그 주인공이다. PF-05082566은 단일클론 항체(완전 인간화 mAb)로 다수의 면역세포에서 발현되는 단백질인 4-1BB를 통해 신호전달을 촉진하는 정맥주사 제제이다.
4-1BB 단백질 수용체는 CD8+ T 세포와 같은 살생세포(killer cell)와 CD4+ T 세포 등과 같은 T 세포에서 발견되는데 PF-2566이 4-1BB와 결합할 때 면역세포의 생성을 촉진하고 면역세포의 수를 증가시키는 것으로 임상에서 확인되면서 종양에 대한 면역기능을 향상시킬 수 있는 것으로 기대가 높은 약물이다.
올해 ASCO에서 재발성 혹은 난치성 CD20+ NHL(비호지킨 림프종) 환자를 대상으로 PF-2566과 리툭시맙(rituximab)을 병용 투여한 1상임상 연구 결과가 나왔는데 추가 독성 없이 항암 효과를 촉진시키는 것으로 밝혀졌다.
http://www.hani.co.kr/arti/science/science_general/836699.html
‘암세포 약물내성을 깨라’ 면역항암제의 치열한 도전

최근 ‘CAR-T’ 등 새로운 치료법 주목
1980~90년대를 돌아보면, 사람들에게 죽음의 공포심을 일으킨 대표적인 질병은 암과 에이즈(AIDS, 후천 면역결핍 증후군)였던 것 같다. 치료제 개발의 관점에서 보면, 에이즈는 현재 관리가 가능한 병이라고 생각할 정도로 치료제 개발에서 눈부신 성공이 있었다. 하지만 (종류와 원인이 워낙 다양한) 암의 경우에는 많은 치료제가 개발되었고 치료 효과를 보는 경우도 많지만 치료에 어려움을 겪는 암도 많기 때문에 여전히 암 질환은 많은 사람들에게 관심의 대상이 될 수 밖에 없다.
1971년 미국 닉슨 정부가 “국가 암 법(National Cancer Act)”을 통과시키며 그 이후 암 정복을 위한 예산을 2000억 달러 이상 쏟아부었다. 그러나 2008년 시사잡지 <뉴스위크>에 “우리는 암과의 전쟁에서 졌다”라는 글이 기고된 것만 보더라도, 암 정복을 위한 결과물이 처음 예상과 큰 차이가 있었음을 쉽게 알 수 있다. 45년이 지난 2016년 오바마 정부에서 “암정복 국가정책(National Cancer Moonshot Initiative)”을 발표하며 또 다시 암 정복 의지를 표명하였는데, 도대체 암 치료제의 개발은 왜 이렇게 어려운 것일까?사실 수많은 이유들이 존재하지만, 가장 쉬운 대답은 아마도 “암의 생명력, 그리고 치료에 대한 암의 저항성(내성)”이 아닐까 싶다. 현존하는 항생제에 대한 내성(저항성)이 강한 슈퍼박테리아의 출현처럼, 암 역시 뛰어난 생명력을 가지고 있다. 이로 인해 암세포는 자신과 주변 환경을 변화시키고 그 결과로 기존 약물에 대한 내성을 끊임없이 만들어내고 있다. 약물 개발의 관점에서 보자면 항암치료제 개발 과정은 수많은 내성을 만들어 내는 암의 생명력과 벌이는 전투인 것이다. 그렇다면 암 치료제 개발의 과정에서 신약 개발자들이 겪는 “암의 생명력, 내성”에 대해 이야기하기 전에, 박테리아를 통하여 “생명력과 면역, 그리고 내성(저항성)”에 대하여 먼저 간단히 살펴보자.약물 내성의 근원인 박테리아의 생명력항생제는 박테리아, 곰팡이 또는 원생동물과 같은 미생물(병원균)의 성장을 억제하도록 개발된 약물이다. 병원균에 의한 감염증 치료와 수술 등 과정에서 일어날 수 있는 감염을 차단하기 위해 사용된다. 그래서 항생제는 특정한 생물학적 메커니즘을 작동해 미생물의 성장을 억제한다. 하지만 당하는 처지인 미생물의 관점에서 보면 그것은 자신의 생존을 위협하는 척박한 환경이며 생존을 위해 극복해야 하는 위태로운 상황인 셈이다.따라서 미생물 세계에서는 약물에 대한 내성이 상대적으로 강한 유전자를 이미 가지고 있던 개체들이 생존하거나, 돌연변이를 통해서 내성을 획득함으로써 어려운 환경을 극복하고 생존하게 된다. 그래서 특정 항생제에 대한 내성이 강해진 병원균들이 생겨나고 이를 치료하기 위해서는 또 다른 특정 메커니즘으로 작동하는 새로운 항생제가 필요해진다.결국 현재 존재하는 모든 항생제에 내성이 있는 박테리아(미생물)가 생겨나게 되는데, 그것이 바로 뉴스를 통해 종종 듣는 ‘슈퍼박테리아’다. 미생물의 생존이라는 관점에서 본다면, 이들의 생명력이 얼마나 강력한가를 새삼 느낄 수 있는 순간이다.면역과 박테리아의 치열한 ‘철 줄다리기’하지만 강력한 생명력은 우리에게도 있다. 이를 증명하듯이 우리가 가지고 있는 면역 시스템도 우리 생명을 유지하기 위해서 치열한 활동을 한다. 따라서 박테리아가 숙주(인간)에 침입한 이후에 박테리아와 인간 면역 체계는 서로 각자의 생존을 위해서 치열한 싸움을 벌이는데, 이를 극명하게 확인할 수 있는 좋은 예가 바로 ‘철 줄다리기’이다.대부분의 사람들이 알고 있듯이 철(iron)은 필수 영양소로서 헤모글로빈에 결합하여 산소를 운반하는 기능을 한다. 그러나 생명 유지를 위한 철의 역할은 훨씬 다양하며 에너지 대사과정에서도 중요하게 사용되고, 철-황 클러스터(iron-sulfur cluster)의 형태로 여러 가지 작용들에 관여하는 등 다양한 역할을 하는 필수 영양소이다.
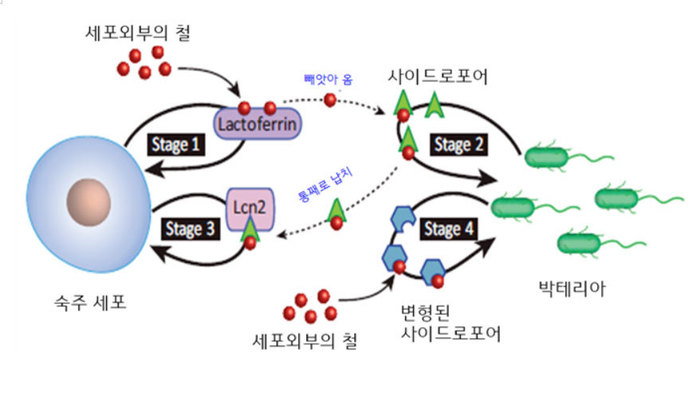
그런 까닭에 감염 중에 숙주(인간)와 박테리아 병원균 사이에서는 철 획득을 위한 격렬한, 생존을 위한 싸움이 일어난다(그림1). 숙주(인간)는 철을 빼앗기지 않기 위해서 철과 결합하여 운반할 수 있는 단백질(Lactoferrin)을 이용하여 철을 운반한다(그림에서 Stage 1). 하지만 박테리아는 사이드로포어(siderophores)라고 불리는 ‘작은 철 결합 분자’를 분비하여 철을 빼앗아온다(Stage 2). 이에 대응하여 숙주(인간) 면역 세포는 철분과 결합한 사이드로포어가 박테리아에 다시 흡수되는 것을 막기 위해 사이드로포어와 결합하는 단백질인 ‘리포칼린 2’(Lcn2, lipocalin 2, 사이데로칼린(siderocalin))를 분비하는데(Stage 3), 이 단백질은 철분과 결합한 박테리아의 사이드로포어를 통째로 결합하는 방법으로 일종의 ‘납치’를 한다. 이 위협에 다시 대응하기 위해 일부 박테리아는 철 결합 분자인 사이드로포어 끝에 당분자(carbohydrate)를 달아서 리포칼린 2가 결합/납치를 못하게 하는 내성이 생기도록 이용한다(Stage 4).참으로 치열한, 생존을 위한 전쟁 같은 줄다리기다. 이렇게 치열한 전쟁이 벌어지는 이유는 분명 “생존/생명력”이다. 박테리아도 생존을 위해서는 철분을 얻어야 하고, 인간도 병원균의 감염으로 병들지 않기 위해서는 철분을 빼앗기지 않아야 하니까 말이다.항암 치료제 약물내성의 여러 원인들얼마 전 화제가 되었던 “암세포도 생명이다”라는, 어느 드라마 속 대사를 생명력의 관점에서만 본다면, 암세포가 위에서 살펴본 박테리아에 못잖다는 점에서 충분히 공감할 만하다. 약물에 대한 내성 때문에 새로운 치료제가 필요한 분야가 바이러스나 박테리아 감염뿐만 아니라 암에도 해당하는 것도 이 때문이다.
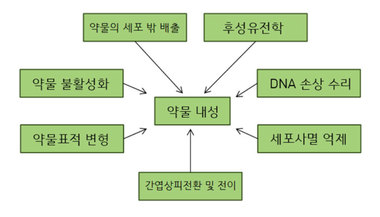
암세포에 약물 내성이 생기는 이유들은 다양하다. 많은 항암제가 약물 효과를 내기 위해 신진대사 활성화 과정을 일으켜야 하는데, 암은 이 신진대사 활성화를 감소시킴으로써 결국에 약물 효과를 감소시키는 내성을 띠게 된다.예를 들어서 급성 골수성 백혈병의 치료에 사용되는 약물인 사이타라빈(cytarabine; AraC)은 신진대사를 통해서 삼인산 사이타라빈(AraC-triphosphate)으로 변환되어야 약물 효과가 나타난다. 이 때문에 암에 의해서 인산화에 관여되는 경로에 돌연변이가 생성되거나 이 대사의 활성화가 감소되면 이 약물의 내성이 생길 수 있는 것이다.또 다른 약물 내성의 원인으로 약물 표적 자체의 변형을 들 수 있다. 약물의 기본 원리는 표적으로 삼는 분자에 정확히 결합해 질환과 관련된 그 약물 표적의 통상적인 역할을 막는 것인데, 만일 약물 표적 자체가 변형돼 약물과 표적의 선택적인 결합이 약화되면 약물의 역할을 가로막는 약물 내성이 생긴다. 가장 쉬운 예는 폐암치료제로 사용되는 표피성장인자 수용체(EGFR)를 약물 표적으로 삼는 타이로신 카이나제 저해제(tyrosine kinase inhibitor) 약물들이다. 이 약물로 치료하는 경우, 1년쯤 안에 약물 표적인 표피성장인자 수용체에 변형이 나타나 약물 내성을 보이는 것으로 알려져 있다.물론 연구자들은 다시 이런 변형에 효과를 내는 새로운 약물을 개발하곤 하지만 약물에 노출되는 시간이 길어지면, 그 약물에 대해 또 다른 변형들이 생겨 약물은 제대로 작동하지 못한다. 앞에서 얘기한 ‘철 줄다리기’ 같은 반복되는 싸움이 암과 신약 연구자들 사이에서도 일어나며, 이러한 까닭으로 3세대, 4세대 약물들이 계속 연구되고 있다.면역항암제와 약물 내성들많은 분들이 여러 매체들에서 ‘면역항암제’에 관한 얘기를 한 번쯤은 들어봤을 것으로 생각된다. 최근 여러 가지의 치료제들이 임상에서 좋은 치료 결과를 보였고, 미국식품의약국(FDA) 허가를 받았으며, 이제는 항암 치료에서 큰 흐름이 면역항암제로 이미 넘어가고 있다고 해도 과장은 아닐 것 같다.기존의 항암제들과 달리 면역력을 올려서 암을 치료하고자 개발되는 면역항암제에서는 위에서 언급한 약물 내성이 생기지 않을지도 모른다는 기대가 있었다. ‘철 줄다리기’에서 확인했듯이 면역이 활성화되면 저절로 2차, 3차의 대응이 가능하도록 작동할 것이라 믿었기 때문이다. 하지만 FDA에서 승인된 면역항암제들에서도 약물 내성이 발견되기 시작하였으며, 이 때문에 면역항암제의 개발 과정에서도 ‘철 줄다리기’ 같이 반복되는 싸움에서 벗어나기 위한 전략이 다각적으로 고려되고 있다.그렇다면 면역항암제 개발과 관련되는 약물 내성에는 어떤 것들이 있을까?
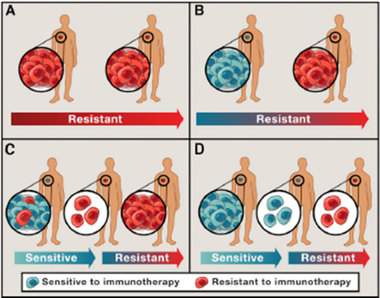
사실 암세포가 자라고 있다는 것 자체가 인간의 일상적인 면역 시스템의 감시를 암세포들이 성공적으로 회피했다는 것이니 이미 암의 1차 공격(면역에 대한 내성/저항성)이 성공한 상태라고 봐야 할 것이다. 면역을 회피하는 방법은 다양하지만 한 가지 예를 자세히 살펴보자.선천적으로 면역은 외부 침입에 대응하여 면역반응을 보이는데, 그 면역반응은 외부 침입자에 대한 결투가 끝나면 사라지도록 설계되어 있다. ‘피디-엘1(PD-L1)’이라는 리간드 분자도 그런 ‘면역반응 염증의 종료’ 시점을 알려주는 시그널로 작용한다. 면역세포 표면에 나타난 PD-L1 리간드 신호와 또 다른 면역세포의 표면에 나타난 ‘피디-1(PD-1)’이라는 수용체 분자가 결합함으로써 ‘면역반응 종료’가 이뤄지는 것이다.하지만 면역반응을 피해야 하는 암이 이 기능을 차용하면 어떻게 될까? 암세포가 PD-L1(리간드)를 발현시키면, 면역세포들은 면역반응 종료 신호로 오인해 공격을 멈춘다. 그럼으로써 암세포는 면역에 의한 항암 효과를 회피할 수 있다.FDA가 허가한 면역항암제에는 PD-1(수용체)/PD-L1(리간드)의 결합을 차단하는 항체들이 있는데, 이 항체들은 암세포가 PD-L1 리간드를 발현해 면역 감시를 회피하는 것을 막는 기능을 한다. PD-1(수용체)/PD-L1(리간드)의 결합을 차단하는 항체들이 좋은 효능과 낮은 부작용의 측면에서 좋은 결과를 보이고 있지만, 이 경우에도 전체적인 반응률이 15-20%(예를 들어 폐암의 경우)에 머무르고 있어서 그 한계 또한 명확한 상황이다.PD-1/PD-L1 차단 항체의 효능과 한계를 모두 설명할 수 있는 단어가 바로 내성이다.
연구를 통해서 이러한 선천적인 내성을 지닌 암의 면역 회피 원리(위에서 설명한 암의 1차 공격)를 확인한 과학자들이 암세포와 면역세포 간의 결합을 차단하는 항체를 개발한 것은 암의 선천적 내성(면역에 대한 저항성)에 대한 과학자들의 반격인 것이다. 또한 제한적인 반응률 역시 또 다른 종류의 내성 메카니즘이 작동하기 때문이다.그렇다면, PD-1/PD-L1 차단 항체에 의한 과학자들의 반격 이후 모습은 어떨까? PD-1 항체의 치료에 초기 효과를 보이던 환자들 중 일부에게서 점차 같은 약물로 항암 효과를 볼 수 없는 경우가 관찰되었고, 그 원인들을 분석하였는데 대략 다음과 같다.암세포가 PD-1/PD-L1을 통하여 면역세포를 회피하는 것은 항체를 통해서 막았지만, 암세포는 또 다른 메커니즘을 이용한 내성으로 면역세포의 공격을 또 다시 회피하는 것으로 나타났다. 우선 암세포를 식별하는 데 필요한 단백질(MHC I의 일부인 b2M)이 제거, 변형되거나(이 경우 암세포의 식별이 어려워짐), 또는 그 하위의 신호전달에 중요한 단백질(JAK)에 문제가 생겨(암세포를 식별했다는 시그널을 통해 면역세포 활성화가 이루어져야 하는데, 그 신호전달 통로가 막힘) 면역세포가 공격 불능 상태에 빠지는 것이 확인되었다. 생존을 위한 암세포의 재반격(통상적인 의미의 약물 내성)은 끝나지 않고 면역항암제 치료에도 계속되는 것이다.이런 까닭에 연구자들은 한 가지 방법으로 암을 극복하지 못하는 경우 여러 가지 약물들의 협공으로 암을 정복하고자 수많은 조합의 협공 방법에 대한 임상실험을 진행 중이다.
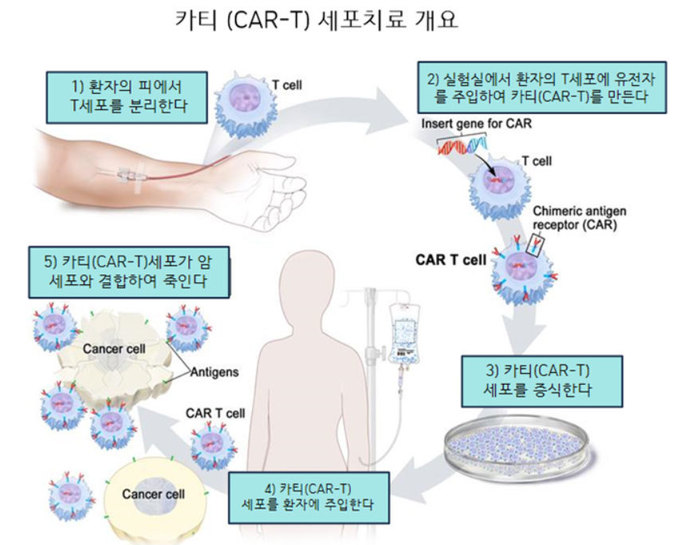
CAR-T와 ‘재정적 내성’2017년은 항암치료제 개발에서 새로운 이정표를 세운 해이다. FDA에서 허가를 받은 카티(CAR-T, chimeric antigen receptor T cell)라는 세포치료제가 혈액암에서 높은 치료 성공률을 보이고 있어서 희망을 주고 있기 때문이다.CAR-T는 환자의 면역세포(T세포)에 유전적인 처리를 하여, 암세포 표면의 약물 표적을 인식함과 동시에 공격할 수 있도록 T세포들의 공격 능력을 더욱 높인 치료제이다. 앞에서 설명한 암세포의 다양한 면역회피 방법들을 한 번에 극복하기 위한 방법인 것이다.지금 허가된 CAR-T의 경우를 살펴보면, 여전히 약물 작용과 부작용의 관점에서도 개선해야 할 문제들이 존재하기는 하지만, 가장 먼저 개선해야 하는 문제는 비싼 치료비, 즉, “재정적 내성(Financial Resistance)”이 크다는 점이다. 한번 치료를 받는 데 들어가는 비용이 4억~5억 원이고, CAR-T 투여 가격에다 치료에 필요한 비용을 합하면 10억 원 넘게 비용이 들기 때문에 경제적인 여유가 충분하지 않다면 쉽게 사용하기 힘든 치료법이다. 연구자들은 이러한 새로운 재정적 내성을 극복하기 위한 방법에 대해서도 연구 중이다. 환자로부터 T세포를 분리하고 처리하는 방식이 아니고, 이미 만들어 놓은 기성품인 CAR-T를 사용할 수 있는 방식(OTS, Off the Shelf 방식)에 대한 연구가 바로 그것이다.위에서 살펴보았듯이 항암 치료제 개발을 위해서는 극복해야 하는 수많은 내성/저항성들이 존재한다. 이런 많은 내성/저항성들의 근원에는 “철 줄다리기”에서 보았던 박테리아의 “생명력”과 비교할 수 있는 암들의 “생명력”이 존재한다. “암세포도 생명이다”라는 드라마 대사와 무관하게, 암세포의 생명“력”만은 부정할 수 없는 존재이다. 그리고 그 생명력에서부터 기인하는 여러 가지 내성/저항성의 극복이 암 정복을 위한 연구자들의 궁극적인 목표가 될 것이다.극복해야 할 대상이 분명하니 암의 내성/저항력을 무력화시키기 위한 2차, 3차 공격을 준비하는 신약개발 과학자들의 연구에는 가속도가 붙고, 가까운 미래에는 인류가 암에 의한 죽음의 공포로부터 해방되기를 진심으로 기원한다.
http://news.chosun.com/site/data/html_dir/2018/10/03/2018100302714.html?utm_source=naver&utm_medium=original&utm_campaign=news
‘스스로 납득될 때까지’
물리 선생님 별명이 ‘대뿌리’였다. 그걸 훈육봉 삼아 가르쳤다. 그런데 물리 법칙을 칠판에 써놓고 탁탁 치면서 무조건 외우라 했다. 왜 그런지, 어떻게 검증된 건지 답답했지만 현실이 따라주지 못했다. 수학 논리도 그냥 외웠다. 50분 동안 33문제 풀려면 원리 따윈 생각할 겨를이 없었다. 일단 정답부터 생산해야 했다. 스승 탓이 아니다. 그 시절 우리 교육이 그랬다. 점수는 손에 쥐었으나 납득은 못 했다.
▶ 일본 교수가 미국 학자와 함께 올해 노벨 생리의학상을 받았다. 암을 이기는 면역 메커니즘을 규명한 공로다. 엊그제 수상 발표 날 그는 “다른 사람이 쓴 것을 믿지 않고 내 머리로 생각해서 납득될 때까지 연구하는 것이 내 방식”이라고 했다. 신문은 ‘스스로 납득될 때까지 어떤 연구도 안 믿는다’고 제목을 달았다. 수상자 일흔여섯 혼조 다스쿠(本庶佑) 교수는 실제 ‘내 손으로 검증하지 않은 연구는 내 것이 아니다’는 인생을 살아왔다.

▶ 학술지 사이언스는 외부 원고를 받으면 일단 편집회의에서 ‘심층 심사’로 넘길지를 거른다. 80~90%는 이 단계에서 탈락한다고 한다. 전문위원들이 문턱을 넘은 원고를 넷으로 나눈다. ‘그대로 실음’ ‘조금 손봄’ ‘중간쯤 고침’ ‘크게 수정 요함’이다. 이걸 거쳐야 실린다. 그런데 혼조 교수는 이렇게 네이처·사이언스에 실린 연구도 “90%는 거짓말”이라고 했다. ‘내’가 납득 못 했고, 실제 10년 뒤 10%만 남는다고 했다.
▶ 20세기 초 미국에선 펠라그라병으로 해마다 10만명이 목숨을 잃었다. 치사율이 50%를 넘었다. 다들 세균 감염이라 믿었고, 균을 분리해냈다고 주장하는 과학자도 나왔다. 그러나 전염병 학자 골드버그는 믿지 않았다. 그는 환자의 피·분비물·배설물을 직접 제 몸에 넣었다. 괜찮았다. 골드버그는 음식을 파고들었다. 그 덕분에 과학자들은 마침내 필수 영양소 ‘니아신’을 발견했다. 니아신을 보강한 뒤 펠라그라병이 사라졌다.
▶ 덴마크 학자가 기생충이 암을 일으킨다고 하고 1926년 노벨상까지 받았다. 그러나 이를 의심한 다른 학자들이 끈질기게 검증과 연구를 이어간 끝에 타르에서 발암물질 벤조피렌을 찾아냈다. 제 손으로 검증 못 한 어떤 연구도 믿지 않은 결과다. 야구 감독도 투수에게 말한다. “홈런을 맞더라도 스스로 납득할 수 있는 공을 던져라.” 내 아이에게 말하고 싶다. “꼴찌 해도 좋다. 네가 납득할 수 있는 공부를 해라.”
뛰는 질병 위에 나는 ‘면역’
2018 노벨 생리의학상 다시보기
암 치료 패러다임을 바꾼 과학자들
매년 많은 사람들의 목숨을 앗아가는 암. 의학이 발달했다지만 여전히 암은 두려운 질병이다. 2018년 10월 1일 스웨덴 왕립과학원 노벨상위원회는 생리의학상수상자로 제임스 앨리슨 미국 MD앤더슨암센터 교수와 혼조 다스쿠 일본 교토대 명예교수를 선정했다. 두 교수는 인체의 면역시스템을 이용해 색다른 암치료법을 개발한 공로를 인정받았다. 이들의 업적을 파헤쳐봤다.
암 치료제의 3단계 진화
암 치료제는 세대를 거듭하며 진화를 이어왔다. 1세대 암 치료제는 끊임없이 분열하는 암 세포의 특징에 초점을 뒀다. 이에 착안해 세포 분열 자체를 억제하거나, DNA에 손상을 주는 화학적 항암 치료법이 개발됐다. 하지만 이러한 치료제는 정상 세포까지 제거해 백혈구 감소, 탈모 등 심각한 부작용을 수반한다는 문제가 있었다.
이후 암세포만을 선택적으로 공격하는 표적 항암제가 개발됐다. 2세대 암 치료제는 항암 치료법의 부작용을 대폭 줄였지만, 돌연변이가 흔히 일어나는 암세포의 특성까지 포용하지는 못했다. 다양한 특성을 갖는 암세포는 표적 항암제에 대한 내성이 생긴다는 한계가 있었다.
바로 얼마 전까지만 해도 표적 항암제는 최신 항암치료제로 꼽혔다. 하지만 최근 3세대 암 치료제가 떠올랐다. 바로 면역을 바로 잡아 암을 치료하는 방식의 ‘면역항암제’다. 외부의 바이러스가 유입되면 우리 몸의 면역세포가 스스로 바이러스를 공격하듯, 면역항암제는 암세포를 일종의 ‘침입자’로 인식하게 한다. 이때 암세포를 직접 파괴하는 것이 아니라, 면역세포의 능력을 높여 암세포가 가진 독특한 ‘면역세포 회피 능력’을 억제하는 것이다.
부작용과 내성 문제를 모두 해결한 것은 물론, 투여를 중단해도 면역세포들이 이를 기억하고 계속 암세포를 공격하기 때문에 지속적인 암 치료 효과를 보인다. 인류의 오랜 숙원인 ‘암 정복’을 가능하게 한 이 치료제 개발을 이끈 사람들이 바로 올해 노벨 생리의학상을 수상한 두 명의 연구자다.
면역기능 껐다 켰다 하는 스위치 ‘면역관문 수용체’ 발견
우리 몸에는 기본적으로 질병을 이겨낼 수 있는 면역시스템이 있다. 면역시스템의 핵심은 자신(self)과 비자신(non-self)을 분간할 수 있다는 것. 이 중요한 역할을 하는 것이 바로 T세포다. T세포는 평소에 침입자를 공격하는 ‘착한 세포’지만, 때로는 과도한 면역 반응으로 오히려 질병을 유도하는 ‘나쁜 세포’가 되기도 한다.
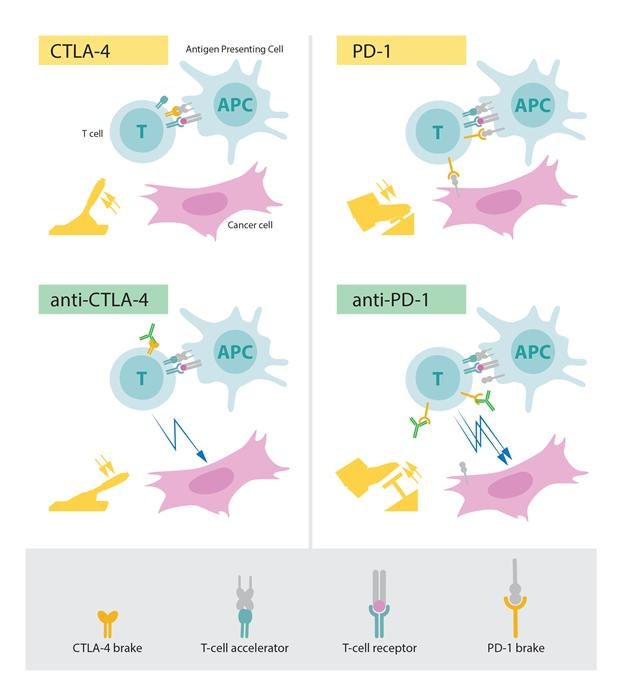
앨리슨 교수의 공로는 한 마디로 이 T세포가 착하거나 나쁘게 변하는 것을 조종하는 ‘스위치’를 발견한 데 있다. 의학적으로는 이 스위치를 ‘면역관문 수용체(immune checkpoint receptor)’라고 한다. T세포를 이용한 자가면역질환 치료는 오래도록 관심 연구대상이었다. 하지만 T세포를 암 치료에 활용하자는 아이디어를 처음 제시한 건 앨리슨 교수다. 앨리슨 교수는 T세포의 활성을 억제하는 단백질인 ‘CTLA-4’의 기능을 억제해, T세포를 활성화시키는 약물을 개발했다.
1994년에는 암을 유발한 실험용 쥐에게 CTLA-4 항체를 주입해, 암세포를 제거하는 실험에도 성공했다. 하지만 이 항체가 인간을 위한 암 치료제로 각광받은 것은 2010년이나 돼서다. 2010년 앨리슨 교수는 피부암의 일종인 흑생종 말기 환자들에게 CTLA-4 항체를 주입한 결과, 20~25% 완치가 됐다는 임상실험 결과를 얻었다. 이후 앨리슨 교수가 개발한 치료제는 인류 최초의 항체 면역 항암제로 자리매김했다.
면역항암제 실용화 단초 마련
비슷한 시기 일본의 연구실에서는 ‘PD-1’이라는 단백질이 발견됐다. 혼조 교수가 발견한 PD-1 단백질 역시 T세포의 기능을 억제하는 ‘브레이크’ 역할을 한다. 이 때문에 PD-1의 항체를 사용하면 T세포를 활성화시켜 암세포를 공격할 수 있다.
PD-1과 CTLA-4의 기능은 유사하지만 작동 원리에 있어서는 차이가 있다. 주변 면역 세포에 의해 활성화되는 CTLA-4와 달리, PD-1은 주로 암세포 표면에 존재하는 특정 단백질에 의해 억제 기능이 활성화돼 T세포를 비활성화한다.
혼조 교수는 PD-1 항체를 다양한 종류의 암 환자들의 임상치료에 적용했다. 이 면역항암제는 ‘옵디보’, ‘키트루다’라는 상품명으로 세상에 나온 최초의 PD-1억제제는 2014년 미국 식품의약국(FDA)의 승인을 받았다. 키트루다는 지미 카터 미국 전(前) 대통령의 뇌종양을 완치시킨 약물로도 유명하다. 옵디보는 2016년 식품의약품안전처의 허가를 받아 국내에 상용화됐다.
면역항암제를 투여 받는 환자는 말기 암 단계에 이른 경우가 많다. 면역항암제는 이런 환자들의 암 크기를 줄이고 아예 없애기까지 했다. 처음에는 악성 흑색종이나 폐암 등에 효과가 나타났지만 점점 대장암, 간암, 위암, 신장암 환자들에게서 기적 같은 완치 사실이 알려졌다.
그렇다고 면역항암제가 만능은 아니다. 아직 한계가 있다. 암환자의 30% 정도에서만 치료 효과를 보인다. 의학자들은 나머지 70%를 위한 면역치료를 위해 지금도 연구에 몰입 중이다. 암은 인류가 정복해야 할 가장 중요한 의학적 도전이기 때문이다.
IBS, 면역세포 간 ‘생존경쟁’이 면역계 균형 유지 비결임을 밝혀
비단 암 치료뿐만 아니라 면역은 건강의 기본이자 필수적인 조건이 된다. 지금도 세계 곳곳의 과학자들이 면역을 연구하는 이유다. 기초과학연구원(IBS) 면역 미생물 공생 연구단 연구진은 지난해 8월 면역세포들이 증식을 위해 서로 경쟁하면서 전체 면역체계의 균형을 유지한다는 흥미로운 원리를 규명하기도 했다.
연구진은 ‘선천성 림프세포(ILCs)’가 면역세포 조절 단백질인 ‘인터루킨-7(IL-7)’을 효율적으로 소비해 체내 다수를 차지하는 ‘T세포’의 증식을 조절한다는 사실을 발견했다. 선천성 림프세포는 선천적 면역을 담당하는 세포이며, T세포는 후천적 면역에서 중심 역할을 한다. 두 세포 모두 백혈구의 30%를 차지하는 림프구로 분류되지만, 주로 후천적 면역세포가 주를 이루며 특히 T세포가 림프구의 절대 다수를 차지한다.
연구진의 발견에 따르면 선천성 림프세포는 T세포에 비해 훨씬 소수지만 T세포보다 IL-7을 보다 효과적으로 소모할 수 있다. 고(故) 찰스 서 IBS 면역미생물공생연구단 단장은 “선천성 림프세포의 이러한 생존법 덕분에 면역체계는 다양성을 유지한다”며 “이 연구는 IL-7을 활용한 면역 치료법 증진에 기여할 것”이라고 설명했다.
유산균제 프로바이오틱스, 목속 ‘면역 선생님’ 역할
지난 10월 20일, 임신혁 IBS 면역 미생물 공생 연구단 교수팀은 국제학술지 ‘사이언스 이뮤놀로지’에 프로바이오틱스가 우리 몸속 면역체계를 교육시키는 ‘면역 선생님’의 역할을 할 뿐만 아니라, 면역과 관련된 질환을 치료하는 신약 후보물질로도 작용할 수 있다는 연구결과를 발표했다. 단순히 건강식품의 범주에 포함되던 유산균제 프로바이오틱스를 이용해 염증성 질환이나 아토피 같은 알레르기 질환을 치료할 수 있는 면역치료제 개발 가능성을 연 것이다.
연구진은 ‘모유 수유를 통해 유익한 장내 미생물이 많은 어린이가 아토피 피부염 같은 면역 과민 질환에 덜 걸린다‘는 사실에 착안, 프로바이오틱스와 면역질환 치료제 간 연결고리를 찾았다. 자체 개발한 분석 시스템을 바탕으로 프로바이오틱스 중 면역세포인 T세포를 활성화시킬 수 있는 균 200여 종을 골라냈다. 이중 건강한 어린이의 분변에서 가장 많이 발견되는 비피더스 PRI1 균을 최종 후보물질로 선정해 분리했다.
이후 장에 염증을 앓는 쥐에 비피더스 PRI1 균을 투여했더니 3주 만에 소장과 대장에 면역조절 T세포가 크게 증식한 것을 확인했다. 장 표면의 염증은 균을 투여하지 않은 쥐에 비해 눈에 띄게 줄었다.
나아가 연구진은 비피더스 PRI1 균의 세포표면다당체(CSGG)가 면역을 활성화하는 물질이라는 사실도 새롭게 규명했다. 이는 ‘프로바이오틱스가 살아 있어야만 효능을 발휘할 것’이라던 기존 상식을 뒤집은 결과다. 특정 프로바이오틱스만 유익한 활성을 지니는 이유에 대해 과학적 근거를 제시했다는 측면에서도 주목할 만하다.
연구진은 오늘도 질병의 예방 차원뿐 아니라 이미 걸린 면역질환의 진행을 늦출 수 있는 치료제를 고민하고 있다. 오로지 면역질환 치료 신념 하나로 그 길을 걷고 있다.
원문: 여기를 클릭하세요~