망간과 카드뮴에 관한 이야기입니다~
(원문: 여기를 클릭하세요~)
오늘은 강철 합금과 건전지에 쓰이는 원소 ‘망가니즈(원자번호 25번, 망간)’에 얽힌 흥미진진한 화학 이야기를 들려드릴게요.
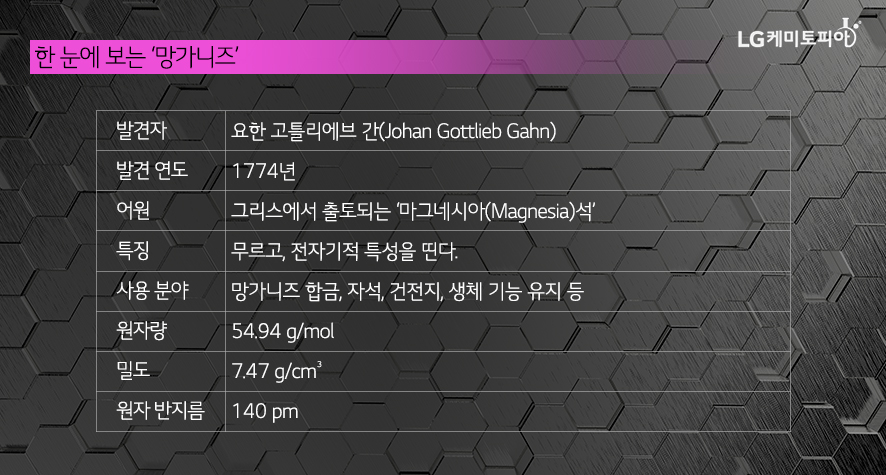
원자번호 25번 ‘망가니즈’를 소개합니다!
지구에 12번째로 많은 원소 망가니즈는 고갈될 일이 거의 없는 원소로 알려져 있습니다. 광산을 채굴해서 얻는 보통의 금속 원소와 달리, 망간은 바닷속에 공 모양의 망가니즈단괴(특정 성분이 농축되어 단단해진 덩어리)가 무려 5,000억t이나 쌓여 있기 때문입니다. 태평양 바닥에 산더미처럼 쌓인 망가니즈단괴를 꺼내는 것은 불가능해 보였지만, 2016년 신기술을 개발하면서 이제는 현실에서 가능해졌습니다. 망가니즈는 지각에도 매우 많은 양이 존재하는데요. 이는 미래의 자원으로 보관하고 있는 셈입니다. 망가니즈는 생명체에 꼭 필요한 필수 무기질이기 때문입니다.
‘망가니즈’가 발견되기까지의 과정, 그리고 원소명의 유래
망가니즈는 자연계에서 보통 연망간석(황동석과 같은 결정구조를 가지는 정방정계에 속하는 광물), 능망간석(육방정계의 광물로서 망가니즈의 주요한 광석)의 형태로 존재합니다. 망가니즈 광물은 아주 옛날부터 채굴되었습니다. 고대 로마에서는 망가니즈를 유리의 옅은 초록색을 없애고 무색이나 투명으로 만들기 위해 이용했고, 중세 때는 망가니즈를 강력한 산화제로 사용했습니다. 이렇듯 망가니즈는 원소로 분리되기 훨씬 전부터 알려져 있었습니다.
18세기 화학자들은 연망간석에서 금속 망가니즈를 분리하기 위해 많은 시도를 했지만 매번 실패했습니다. 이후 1774년 스웨덴의 셀레는 연망간석에서 망가니즈와 바륨을 발견했지만, 이를 원소로 분리하지는 못했습니다. 그리고 같은 해 스웨덴의 화학자 간이 이산화망간을 탄소로 환원시켜 금속 망가니즈를 얻는데 성공하면서 드디어 최초로 망가니즈의 분리에 성공했습니다.
망가니즈(Manganese)의 원소명은 자석을 뜻하는 라틴어 ‘magnes’와 연망간석을 의미하는 ‘magnesia nigra(검은 마그네시아)’에서 유래했다는 설을 포함해 그 밖에도 여러 가지 설이 있습니다. 얼마 전까지 망간로 불리던 망가니즈는 IUPAC(국제 순수ㆍ응용화학 연합) 명명법에 따라 최근 망가니즈(manganese)로 명칭이 통일되었습니다.
‘망가니즈’는 어디에 사용될까요?
철과 알루미늄의 합금으로 강한 힘을 발휘하는 원소
1년에 1,000만t 넘게 생산되는 망가니즈의 90% 이상이 합금 제조에 이용됩니다. 현대 기술에 필요한 거의 모든 종류의 강철에는 망가니즈가 첨가되는데요. 이는 철이 파괴되는 것을 막고 강도를 높일 뿐만 아니라, 제련 과정에서 기포가 발생하는 문제도 해결해 줍니다. 알루미늄에도 망가니즈를 첨가해 합금을 만듭니다. 이렇게 만들어진 알루미늄-망가니즈 합금은 알루미늄 캔, 항공기 몸체 등에 널리 사용합니다.
자석, 건전지, 동전
망가니즈는 우수한 전자기적 특성을 띱니다. 그래서 자석을 만들 때도 소량의 망가니즈를 더해 자력을 강화합니다. 우리가 흔히 사용하는 AA 크기와 AAA 크기의 1.5V건전지에도 망가니즈가 첨가돼 있습니다. 동전에 망가니즈를 넣는 나라들도 많은데요. 이는 자석에 붙을 정도는 아니지만 약간의 자성을 띠게 함으로써 자판기가 동전을 확실하게 인식하도록 돕습니다.
동·식물 필수 무기질
망가니즈는 동·식물의 필수 원소이기도 합니다. 동물의 몸에서는 효소들을 정상적으로 작동하게 하고, 식물에게는 광합성을 가능하게 합니다. 망가니즈가 부족하면 근육 떨림이나 골다공증을 일으키는 반면에 너무 많이 섭취하면 신경이 손상될 수 있습니다. 평소 식사할 때 일반적인 식단으로도 적당한 양을 섭취할 수 있으므로 특별한 경우가 아니라면 크게 신경 써서 챙겨먹지 않아도 됩니다.
오늘은 지각에 세 번째로 많이 포함된 전이금속이며, 다른 전이금속들과 마찬가지로 모든 생명체에게 필수적인 원소 ‘망가니즈(원자번호 25번, 망간)’에 대해 소개해드렸습니다.
(원문 정보: https://m.post.naver.com/viewer/postView.nhn?volumeNo=16601480&memberNo=29922182)
오늘은 색깔이 화려한 화합물을 만드는 원소이면서 빈센트 반 고흐나 클로드 모네와 같은 화가들의 위대한 작품들에서도 발견할 수 있는 원소인 카드뮴(Cd)을 소개해 드리겠습니다.
원자번호 48번 ‘카드뮴’을 소개합니다!
은백색의 금속인 카드뮴은 칼로 자를 수 있을 만큼 부드럽고, 전기 전도성이 뛰어난 특징이 있습니다. 이런 카드뮴은 공해를 끼친다는 인상이 강한데요. 고대 그리스 주물공장의 금속 찌꺼기에도 카드뮴이 함유되어 있던 것을 보아, 그 당시에도 카드뮴으로 인한 공해로부터 자유롭지 못했을 것으로 추정하고 있습니다.
또한, 일본의 4대 공해병 중 하나인 이타이이타이병을 일으킨 원인도 카드뮴이었습니다. 이 병은 1910년 무렵 일본 진즈가와 유역에서 발생한 병으로, 중금속 중독, 환경오염, 원소에 대한 무지 때문에 일어난 대표적인 인재입니다. 당시 수많은 농가 주민이 원인 모를 고통을 호소하다가 뼈가 굽거나 부서져 죽어 갔습니다. 이때 고통이 너무 심해 “이타이 이타이(‘아파, 아파’라는 뜻의 일본어)”라고 밖에 할 수 없었다고 해서 이 병은 ‘이타이이타이병’이라고 이름 붙여졌습니다. 초기에는 정체불명의 풍토병이라고 여겨졌으나 근처 금속 광업 공장에서 흘려보낸 폐수에 있던 카드뮴 때문이라는 사실이 나중에 밝혀졌습니다.
카드뮴은 우리 몸 안에서 문제를 일으킵니다. 카드뮴에 노출되면 염증을 유발하여 감기와 비슷한 발열, 호흡기 장애, 근육통과 같은 증상이 나타납니다. 이런 증상을 ‘카드뮴 블루’라고 부릅니다. 지나치게 많은 카드뮴에 노출되거나 장기간 노출되면 호흡기나 신장에 심각한 장애가 발생할 수도 있습니다. 일반적으로 인체는 독성을 지닌 물질을 흡수하지 않고 바로 배출합니다. 카드뮴은 인체에 필수적인 아연과 화학적 성질이 비슷하기 때문에 체내에 쉽게 흡수됩니다. 카드뮴이 체내에 유입되면 원래 아연이 담당해야 할 효소를 돕는 작용을 방해하여 신장 장애가 발생합니다. 이는 칼슘 대사에 이상을 일으키고 결국 뼛속의 칼슘을 빼앗게 되어, 골절이 발생하기 쉬운 상태로 약화시킵니다. 효소를 제대로 작동하게 만드는 아연의 자리를 차지해 효소의 활동을 방해하기 때문인데요. 따라서 카드뮴은 1급 발암 물질로 분류돼 국가적으로 산업에서 카드뮴 배출은 법률로 엄격하게 규제되어 관리하고 있습니다.
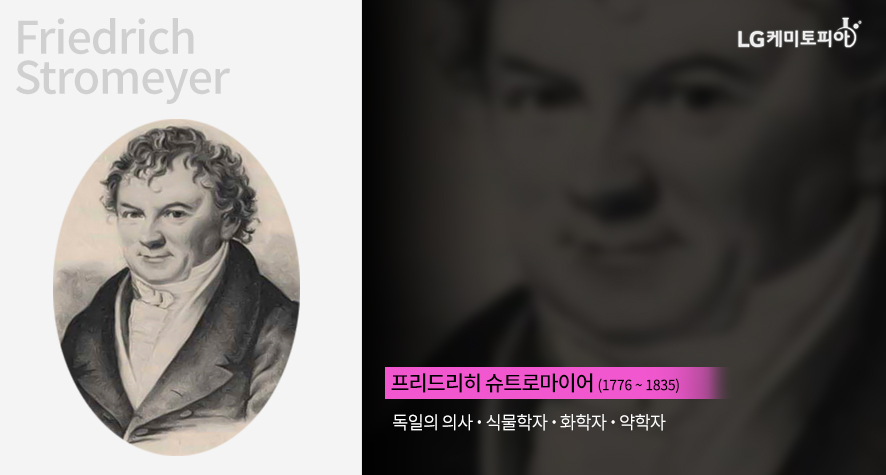
‘카드뮴’이 발견되기까지의 과정, 그리고 원소명의 유래
독일 약국감독장관이었던 슈트로마이어는 약국을 시찰하던 중 카드뮴의 존재를 알게 되었습니다. 당시에는 탄산아연을 태워서 산화아연을 제조했습니다. 원래 흰색이어야 할 산화아연이 노란색이 된 것을 보고 그는 아직 발견되지 않은 원소가 분명 섞여 있으리라 판단했습니다. 그리고 그의 예상대로 아직 발견되지 않은 원소를 분리하는 데 성공했습니다. 그리고 그 원소명은 calamine(산화아연 혹은 탄산아연)의 옛 이름인 그리스어 kadmeia에서 유래해 카드뮴(cadmium)이라고 명명했습니다.
‘카드뮴’은 어디에 사용될까요?
도료
카드뮴이 가장 많이 쓰이는 곳은 페인트, 물감 등의 도료입니다. 카드뮴과 산소족 화합물을 이용해 만든 도료는 코발트, 크로뮴 등의 화합물로 만든 도료보다 색이 선명하고 다양하며 변색이 되지 않습니다. 1840년대부터 예술가들은 카드뮴 염료를 사용하기 시작했습니다. 이러한 빛에 바래지 않는 염료는 빈센트 반고흐나 클로드 모네와 같은 화가들의 위대한 작품들에서 발견할 수 있습니다. 물론 카드뮴으로 만든 도료 역시 체내에 들어가면 중독을 일으킬 수 있으므로 주의해야 합니다. 일부 예술가들은 아직도 카드뮴을 기반으로 하는 염료를 사용하고 있지만, 카드뮴의 독성에 대한 염려 때문에 카드뮴 염료를 대체할 합성염료가 개발되었습니다.
양자 점
카드뮴은 인체에 매우 해로운 중금속이지만 첨단 산업에 널리 쓰이고 있습니다. 황, 셀레늄, 텔루륨과 같은 16족 산소족 원소와 결합해 나노입자를 형성하며, 자외선을 쬐면 크기에 따라 다양하고 선명한 색이 나타납니다. 이처럼 크기를 나노미터로 줄였을 때 전기적, 광학적 성질이 변하는 반도체 나노입자를 ‘양자 점(quantum dot)’이라고 합니다. 양자 점은 고해상도 디스플레이 제작에 활용되며, 독성 유출 방지 처리를 거쳐 바이오이미징(bioimaging, 생체 현상을 촬영해 영상화하는 기술), 바이오센서(biosensor, 생물학적 요소를 적용해 분석 물질의 유무를 탐지하는 기술) 등에 쓰입니다.
그 밖의 카드뮴 사용
1930년대에 자동차 차체나 비행기 동체에 아연도금의 수요가 커지면서 아연의 수요가 증가할 때까지는 카드뮴의 생산이 그리 많지 않았습니다. 아연과 마찬가지로 항공 산업에서 전기도금한 판을 제작할 때 카드뮴도 때로는 도금에 사용됩니다. 1970년대에는 황화카드뮴이 오늘날의 황화아연과 같이 플라스틱에 사용되었습니다. 그러나 카드뮴의 독성에 대한 염려 때문에 그 수요는 계속 줄어들었습니다. 유럽연합에서는 1990년대 들어와 플라스틱, 그리고 보석과 화장품에까지 카드뮴 사용을 금지했고 2011년에는 카드뮴 사용을 전면 금지했습니다. 그런데 1980년대 이후 카드뮴 판이 음극을 이루고 있는 니켈카드뮴 2차전지(NiCad)의 사용이 늘어나면서 카드뮴의 수요가 다시 증가했습니다. 최근에는 또 다른 전지인 수소화금속니켈(NiMH) 전지가 더 많이 사용되고 있습니다. 이 전지는 값이 싸고 독성이 있는 카드뮴을 포함하고 있지 않습니다.
오늘은 색깔이 화려한 화합물을 만드는 원소로, 빈센트 반 고흐나 클로드 모네와 같은 화가들의 위대한 작품들에서도 발견할 수 있는 원소 카드뮴(Cd)을 소개해드렸습니다.