(원문: 여기를 클릭하세요~)
선거 날 투표 결과를 기다리는 두근거림은 아무것도 아닐 정도로 학위 논문 발표는 엄청난 긴장감을 유발한다. 특히 심사위원들의 쏟아지는 질문은 대부분 논문의 가설, 실험 방법, 결과 등에 대한 것이지만 매우 기초적인 내용을 포함하기도 한다. “물의 분자구조를 칠판에 그려 보겠나?” 등이 그것이다.
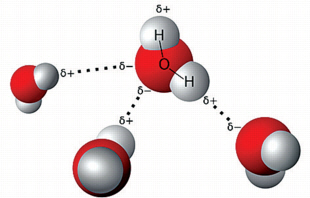
이 질문은 화가의 자질을 알아보기 위한 질문이 아니라 산소와 수소 원자가 어떤 방식으로 결합하는지를 묻는 것이고 물의 성질을 이해하는 데 매우 중요하다. 답은 ‘-’(음) 전하를 띤 전자를 공유하는 방식으로 하나의 산소와 두 개의 수소가 결합해 물 분자를 이룬다는 것이다. 이 결합에서 전자가 산소 쪽으로 쏠리면서 물 분자의 산소 쪽은 ‘-’, 따라서 물 분자의 수소 쪽은 상대적으로 ‘+’를 띠게 된다. 그 결과 산소와 결합한 두 수소 원자가 한쪽으로 몰려 있는 형태의 분자가 생긴다. 야구공 한쪽에 두 개의 포도 알이 붙어 있는 그림을 떠올려 보면 물의 특성을 더 쉽게 이해할 수 있다.
그럼 물 분자 사이에서 일어나는 일을 살펴보자. 양성(+)을 띠는 포도 알 각각은 야구공의 음성(-)인 특정 부위와 서로 당기는 결합력이 생기게 된다. 물 분자들 사이에 결합이 생기는 것이다. 이 결합이 물 분자의 기본적인 성질이다.
30m 가까이 되는 미루나무 꼭대기까지 물은 올라간다. 심지어 100m 높이의 미국삼나무 끝까지도 올라간다. 식물은 뿌리를 통해서 물을 흡수하므로 높은 곳까지 물이 이동하는 것은 신기하기만 하다. 식물의 높은 곳에서 증산을 통해 식물체 내의 물이 공기 중으로 날아가면 모자란 물을 보충하기 위해 식물의 낮은 곳으로부터 물을 끌어당긴다. 이때 물 분자끼리의 결합 덕분에 식물의 물관에는 뿌리로부터 물기둥이 형성된다. 또 물 분자끼리의 결합은 표면장력을 만들어 소금쟁이나 예수도마뱀 등의 동물이 물에 빠지지 않고 연못의 수면에서 움직일 수 있게 한다.
안이하게 물의 성질을 무시하면 다칠 수도 있다. 라면을 끓일 때 급한 마음에 물에 손가락을 넣어보고 괜찮아서 냄비를 만지면 데기 십상이다. 금속과 달리 물을 끓게 만들기 위해서는 물 분자끼리의 결합을 끊어야 하기 때문에 많은 에너지가 필요하다. 동일한 양의 열에 노출되더라도 물의 온도 변화는 작은 편이란 말이다. 무더운 여름날 바닷가 근처의 기온이 크게 오르지 않는 이유도 이 때문이다. 마찬가지로 우리 몸의 70% 전후를 차지하는 물 덕분에 체온을 일정하게 유지할 수 있다. 알코올이 우리 몸을 구성하고 있다면 체온은 오르락내리락 제멋대로일 것이다.
혹한의 겨울철에 해안가나 호숫가로부터 얼음이 언다는 것은 잘 알려진 사실이다. 또 얼음은 물의 표면에 만들어지는데 그 이유는 고체인 얼음의 물 분자 밀도가 액체 상태의 물보다 작기 때문이다. 이렇게 바다, 호수, 강 표면에 얼음이 만들어져 얼음 아래는 비교적 덜 추운 조건이 되면서 수중 생물들이 생존하는 데 더 유리하게 된다.
물은 여러 종류의 물질들을 잘 녹이기도 한다. 물은 우리 몸에 있는 10만 가지 이상의 단백질 중 상당 부분은 물론 DNA나 RNA 등 우리의 생존과 유전에 필수적인 분자들을 담고 있다. 또 세포막의 전기를 유지하고 많은 효소의 활성에 관여하는 다양한 이온과 여러 종류의 분자들도 녹일 수 있다. 그래서 화학자들은 생명현상을 유발하는 화학반응이 대부분 물속에서 일어난다고 해서 ‘젖은 화학’이라고 부르기도 한다.
이처럼 물은 모든 생물의 생존에 필수적인 존재다. 이런 물이 우리의 일상에서는 제대로 대접을 받지 못하는 것 같다. 뭔가 모자라 보인다는 의미로 ‘물로 본다’는 말을 쓰는 것만 봐도 그렇다. 이제는 발상을 바꾸어야 할 것 같다. 우리가 무심하게 지나가는 중에도 물은 옆에서 중요한 역할을 묵묵히 수행하고 있다. 혹시 내 옆을 지켜주다 조용히 멀어진 이가 있다면 고마운 물처럼 다시 한번 그 소중함을 되새겨 보자.