(원문)
불량 유전자 잘라 정상으로 바꿔… 사람에게도 적용 가능성 높아져
과학자들이 개에게서 치명적인 근육 손상을 일으키는 ‘불량 유전자’를 정상 유전자로 바꾸는 데 성공했다. 생쥐와 인간 세포에서 같은 방법이 적용된 적은 있지만 개와 같은 대형 포유동물에서는 처음 성공했다. 이에 따라 사람에서도 같은 유전자 교정이 가능하다는 기대감이 높아지고 있다.
에릭 올슨 미국 텍사스대 사우스웨스턴병원 교수가 이끈 국제 공동 연구진은 지난달 30일 국제학술지 ‘사이언스’에 “듀센(Duchenne)형 근위축증에 걸린 비글 종(種)에 유전자 가위를 주입해 질환을 유발하는 유전자를 교정했다”고 발표했다.

듀센형 근이영양증에 걸린 비글들(위). 유전자 가위로 질병 유전자를 제거하자 근육을 만드는 단백질이 다시 증가했다(아래). /영국왕립수의대·사이언스
유전자 가위는 특정 유전자 부위를 잘라내는 효소 단백질이다. 듀센형 근위축증에 걸리면 근육세포를 구성하는 핵심 단백질인 ‘디스트로핀’이 제대로 합성되지 않는다. 전 세계 환자 수는 30만명 정도인데 대부분 20대에 심장 근육 기능이 멈춰 사망한다.
연구진은 근위축증에 걸린 생후 1개월 비글 2마리에 유전자 가위를 실은 무독성 바이러스를 주입했다. 8주 후 몸속 근육세포를 보니 디스트로핀이 정상적으로 합성된 것을 확인했다. 연구진에 따르면 정상 개와 비교해 디스트로핀 합성이 심장에서 92%, 횡격막에서 58% 정도까지 회복된 것으로 나타났다. 연구진은 “유전자 가위가 불량 유전자를 잘라내 정상 유전자로 대체되면서 단백질이 생성된 것”이라고 밝혔다.
앞서 지난 4월 김진수 기초과학연구원(IBS) 유전체교정연구단장은 생쥐에서 근위축증을 야기하는 유전자를 바꿔 치료에 성공한 바 있다. 올슨 교수는 “이번 연구를 발전시키면 근위축증을 앓는 환자들이 심장 박동 기능 소실이나 횡격막 호흡 기능 약화로 사망하는 비극을 크게 줄일 수 있을 것으로 기대된다”고 밝혔다.
http://biz.chosun.com/site/data/html_dir/2017/10/29/2017102900319.html
거스를 수 없는 대세 ‘유전체 혁명’…염기부터 RNA까지 교정 기술도 급속 진화
유전체 분석과 유전자 가위 기술로 대표되는 유전자 연구가 인류가 풀지 못한 다양한 질환의 원인을 규명하는 데 핵심적인 역할을 하고 있다. 환자 유전체 빅데이터를 이용해 자폐증 유발 유전자를 찾는가 하면, 질병을 유발하는 특정 유전자를 교정하는 유전자가위 기술의 급격한 발전으로 세대를 거듭하며 대물림되는 유전질환을 근본적으로 치료할 수 있다는 기대감도 커지고 있다.
◆ 자폐·치매 등 무서운 정신질환 원인 속속 규명
한국 아동의 자폐증 유병률은 미국의 2배가 넘는다. 지난 2011년 심리 질환 분야 국제 학술지 ‘미국정신의학회지(American Journal of Psychiatry)’에 발표된 논문에 따르면, 한국 자폐증 유병률은 7~12세 아동의 2.64%에 달한다. 미국의 경우 질병관리센터(CDC)의 미국 아동 자폐증 유병률(1%)보다 크게 높다.
이정수 한국생명공학연구원 질환표적구조연구센터 박사 연구팀과 충남대 김철희 교수 연구팀, 김형구 미국 오거스타주립대 교수 연구팀은 공동연구를 통해 그동안 다운증후군의 원인 유전자로만 알려졌던 ‘DYRK1A’ 유전자가 자폐증의 원인 유전자가 될 수 있다는 사실을 처음으로 규명하고 학술지 ‘분자자폐증(Molecular Autism)’ 온라인판에 27일 발표했다.
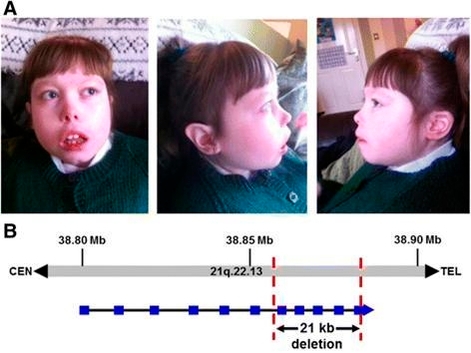
자폐증 환자의 유전체 연구를 통해 염색체 21번의 미세결손에 의한 DYRK1A 유전자가 자폐증의 원인임을 규명했다./생명연 제공
이정수 생명연 박사와 김철희 충남대 교수, 김형구 오거스타주립대 교수 연구팀은 대량 염기서열과 유전체 분석을 통해 DYRK1A 유전자가 자폐증과 관련성이 매우 높을 것이라는 사실에 주목했다.
연구팀은 유전자가위 기술로 DYRK1A 유전자 변이 제브라피쉬를 만들었다. 제브라피쉬는 잉어과에 속하는 얼룩말 줄무늬가 있는 열대어로 로 사람과 비슷한 유전자를 갖고 있어 의학 분야 실험에 많이 활용된다.
연구팀은 제브라피쉬는 무리를 이루려는 습성이 있는 데, DYRK1A가 정상적으로 작동하지 않으면 사회성이 현저히 떨어진다는 것을 실험으로 검증했다.
지난 9월에는 미국 워싱턴 의대 연구진이 ‘ApoE4’ 유전자의 변이가 치매를 악화시키는 원인이라는 사실을 밝혀내고 국제 학술지 ‘네이처’에 발표했다. ApoE4 유전자 변이가 치매를 유발할 수 있다는 사실을 이미 알려졌지만 이 연구에서는 ApoE4 유전자 변이가 특정 단백질과 결합해 치매를 더욱 악화시킨다는 것을 추가로 밝혀낸 것이다.
이정수 생명연 박사는 “전체 유전체(게놈) 분석이 가능해지면서 치매나 자폐 같은 정신질환의 유전적 원인이 무엇인지를 언급할 수 있는 시대가 됐다”며 “질환 유발 후보 유전자들을 검증하는 단계에서 유전자 가위를 이용해 변이를 만들어 실제로 유전자의 기능을 검증할 수 있기 때문”이라고 말했다. 그는 또 “유전자의 기능을 명쾌하게 검증하면 특정 질환을 완화시킬 수 있는 타깃 물질 개발이나 유전자 교정 등을 할 수 있게 된다”고 말했다.
◆ 유전자 교정 기술도 빠른 속도로 진화
2년 전만 해도 생명과학 분야에서 가장 혁신적인 기술로 꼽힌 3세대 유전자 가위 기술인 ‘크리스 유전자 가위’ 기술도 빠른 속도로 진화하고 있다. 미국 메사추세츠공과대학(MIT)과 하버드대가 공동으로 설립한 연구기관인 ‘브로드연구소’ 소속 데이비드 리우 하버드대 교수와 펑장 MIT 교수는 지난 26일 더 정확하고 부작용이 없는 유전자 교정 기술을 개발, 국제 학술지 네이처와 사이언스에 나란히 공개했다.
유전자 가위 기술은 문제가 생긴 염기를 특정 효소(단백질)를 이용해 잘라내고 정상 DNA를 붙이는 유전자 교정 기술이다. 3세대 유전자가위 기술인 크리스퍼 유전자가위 기술은 정확도와 효율성이 가장 좋다는 평가를 받고 있다. 하지만 DNA 절단 과정에서 정상 DNA를 자르거나 교정된 DNA에서 또다른 변이가 일어날 가능성이 있는 이른바 ‘오프타깃(Off Target)’ 현상이 문제였다.

데이비드 리우(사진) 교수 연구진은 문제가 있는 DNA 염기의 이중 가닥을 잘라내지 않고 DNA 염기 4개(A, T, G, C) 중 특정 염기 하나만 다른 염기로 대체해 교정할 수 있는 기술을 개발했다. 단일 염기 돌연변이를 의미하는 ‘점 돌연변이’에 의한 유전질환의 절반에 가까운 약 48%의 유전질환을 이해하고 치료하는 길을 연 것이다.
펑장 MIT 교수(아래 사진, 브로드연구소 제공) 연구진은 특정 DNA에만 결합하는 유전물질인 RNA를 교정하는 데 처음으로 성공했다. RNA는 생명체 정보를 담는 DNA 이중나선 구조의 유전정보에 따라 생명체에 필요한 단백질을 합성하는 역할을 하는 물질이다. 특정 DNA와 결합해 DNA가 담은 유전 정보를 전달하는 일종의 복사본인 셈이다.

RNA 교정은 DNA 교정에 비해 안정성이 떨어지고 통제가 어렵지만 특정한 상황에서는 효과가 있기 때문에 RNA 수준의 유전체 교정 연구가 활발히 이뤄지고 있다. 과학계는 RNA 수준의 유전자 교정이 생명과학 분야에서 획기적인 치료법과 응용법으로 발전할 수 있을 것으로 기대하고 있다.
https://www.nature.com/articles/d41586-018-06195-6?utm_source=feedburner&utm_medium=feed&utm_campaign=Feed%3A+nature%2Frss%2Fcurrent+%28Nature+-+Issue%29
First test of in-body gene editing shows promise
Preliminary results suggest that treatment for rare disease is safe, but its effectiveness is unclear.
A therapy that edits genes directly in the human body might be safe, suggest early findings from the first trial to test the approach.
Researchers from Sangamo Therapeutics in Richmond, California, designed enzymes to correct an error in the genome of people with a rare genetic disease called Hunter syndrome, who cannot break down some complex sugars. The scientists used a virus to deliver these gene-editing enzymes into the cells of patients.
The company presented the results on 5 September at the annual meeting of the Society for the Study of Inborn Errors of Metabolism in Athens. The data on the efficacy of the approach come from just four people enrolled in the study for 16 weeks. Although there are some signs that the treatment reduced levels of a biochemical marker used to assess the severity of Hunter syndrome, it is too soon to know whether the therapy worked.
Hunter syndrome is caused by mutations that disable an enzyme called iduronate-2-sulfatase (IDS), which is responsible for breaking down certain complex sugars in the body. When those sugars accumulate, they can damage organs including the lungs, heart and brain.
Some people with Hunter syndrome now receive infusions of the IDS enzyme to replace the damaged version. But the healthy enzyme is rapidly depleted, and patients must return every week for a fresh dose.
Mixed results
The Sangamo team looked for ways to permanently replace the enzyme. The company designed gene-editing enzymes called zinc finger nucleases to insert a healthy version of the gene into a region of the genome deemed to be safe. The researchers then used a virus to shuttle DNA that encodes the nuclease, and the healthy IDS gene into liver cells, where IDS is normally produced.
This is an improvement over conventional gene-therapy methods, which do not allow researchers to control where the healthy gene is inserted. That uncertainty has raised concerns that the insertion itself could damage an important gene.
Two of the people in the Sangamo trial showed a decrease in urine levels of the sugars that IDS breaks down. The other two, who received a lower dose, saw no change. No patient report any serious adverse events linked to the therapy.
But researchers failed to detect a concurrent increase in the amount of IDS enzyme in the blood. Sangamo president Sandy Macrae says the company is working on a more sensitive assay capable of detecting low levels of the enzyme, and speculated that the enzyme might be rapidly taken up from the blood by IDS-starved tissues. A clearer answer might emerge as the company tests higher doses of the treatment, he added.
That explanation might not have been enough to placate investors: Sangamo’s stock dropped by 22% in the hours after the presentation.
The data are also difficult to interpret because patients in the trial continued to receive IDS-replacement therapy. A safety panel will evaluate the data later this year to determine whether the trial participants can be weaned off of the treatment, allowing researchers a clearer glimpse into the effects of Sangamo’s editing strategy.
An edited future
Gene editing is a topic of intense interest, due in large part to the development of a powerful technique called CRISPR–Cas9. But although CRISPR–Cas9 is easier to design and use in the laboratory, researchers have more experience using zinc finger nucleases to tinker with genomes.
Previous studies have used zinc finger nucleases to alter the genomes of cells that had been removed from the body. Those treated cells were then infused back into the donor, but Sangamo’s latest trial is the first to perform the editing directly in the body.
Sangamo’s approach differs from what some would define as ‘true’ gene editing — the use of enzymes to rewrite a mutation and correct it to the healthy DNA sequence — instead introducing an entirely new copy of the gene.
Nevertheless, the Sangamo trial is an important advance for the field, says Marianne Rots, a geneticist at University Medical Center Groningen in the Netherlands. “Obviously, the true gene-editing excitement is in the actual correction of the mutated gene, but this gene-addition study is an important step forward,” she says. “Its outcomes definitely are of interest to a broad range of diseases.”