How did researchers react so quickly to the SARS-CoV-2 epidemic? Nature Medicine has asked some key experts.
“The reason we were able to go so fast this time is we’ve been working on solutions for coronaviruses for several years now,” says Barney Graham, Deputy Director of the Vaccine Research Center at the US National Institute of Allergy and Infectious Diseases (NIAID) in Bethesda, Maryland, who is overseeing the development of a vaccine candidate.
Weeks before the World Health Organization (WHO) declared the novel coronavirus, also called ‘2019-nCoV’ or ‘SARS-CoV-2’, a public-health emergency of international concern, research groups around the globe had already swept into action, sequencing and sharing the viral genome and studying how the virus infects human cells.
The similarity of SARS-CoV-2 to the coronaviruses that cause the respiratory syndromes MERS and SARS, which both broke out in the past two decades, has enabled rapid studies of diagnostic tests, antiviral strategies and vaccine candidates, many of which will reach phase 1 clinical trials by mid-2020.
How was a diagnostic test released so quickly?
By the time Shanghai Public Health Clinical Center & School of Public Health released the first genome sequence for SARS-CoV-2, work was already underway to develop a diagnostic test.
Along with researchers at the University of Hong Kong, virologist Christian Drosten and his team at the German Center for Infection Research at Charité in Berlin developed an assay that accurately detects SARS-CoV-2 in samples from nose and throat swabs or sputum of hospitalized patients. Their protocol was quickly distributed to public-health authorities around the world.
Because they did not have access to samples of the virus, Drosten’s team worked from their knowledge of SARS-CoV-2’s close relative, the SARS coronavirus (SARS-CoV). They put together genetic sequences for a PCR test based on a SARS-CoV genome, and when the SARS-CoV-2 sequence was released, they picked the two closest matches: genes encoding the envelope protein and RNA-dependent RNA polymerase. The test is built so that sequences from SARS-CoV can serve as positive controls. To avoid cross-reactivity with SARS-CoV or other coronaviruses, the test detects a region of the gene encoding RNA-dependent RNA polymerase that is unique to SARS-CoV-2.
BGI Genomics, a sequencing company based in Shenzhen, China, has developed a detection kit for SARS-CoV-2. It was distributed under an emergency authorization from China’s National Medical Products Administration.
BGI is collaborating with European companies to manufacture the test in Europe; at least a dozen other companies are developing their own commercial versions of the PCR test; and the US Centers for Disease Control and Prevention has begun distributing its own kit to approved labs under and emergency use authorization granted by the US Food and Drug Administration.
If used properly, the diagnostic test should remain reliable, says NIAID virologist Vincent Muster. The genes used for the diagnostic test are not prone to mutation, he says, and according to an analysis of 24 full-length genomes posted on virological.org on 24 January 2020, of viral isolates released on 23 January, there is very limited genetic diversity between isolates. Analyses done since then have continued to find limited diversity.
Credit: JEFF PACHOUD/Contributor/AFP/Getty
How similar is SARS-CoV-2 to SARS CoV, and how many isolates do we have?
SARS-CoV-2 was initially grown in cells and isolated at the Wuhan Institute of Virology. Virologist Zheng-Li Shi and her team found that the viral genome is 79.5% identical to that of SARS-CoV.
Using an infection challenge on cell lines exogenously expressing the protein, her team also found that the virus enters cells through the receptor ACE-2—the same receptor used by SARS-CoV—via a spike protein that SARS-CoV-2 shares with other coronaviruses. Therefore, therapies that interfere with this interaction may be effective against the new virus.
In late January, a lab at The Peter Doherty Institute for Infection and Immunity in Melbourne, Australia, became the first group to grow the virus outside of China. Samples from that lab were distributed to others via the World Health Organization. Isolates are now also available through the European Viral Archive and the NIAID.
Tim Sheahan, a virologist at the University of North Carolina at Chapel Hill, is also working with the Centers for Disease Control and Prevention’s isolate and plans to infect human lung cells grown in a system that accurately models the lung environment by exposing cells to air on one side and fluid on the other. This system will help reveal which subtypes of lung cells are most susceptible to infection by SARS-CoV-2and which drugs are best at entering those cells.
A single-cell level analysis of human lung cells recently released as a preprint on bioRxiv suggests that ACE-2 is most highly concentrated in a type of epithelial cell responsible for producing surfactant, but more studies will be needed to find out if it is also the cell type most affected by infection.
How can existing therapeutics be used against SARS-CoV-2?
A combination of two human immunodeficiency virus (HIV) antivirals, lopinavir and ritonavir, has been taking center stage as a potential therapeutic for COVID-19, the name given to the syndrome associated with SARS-CoV-2.
China’s National Health Commission has recommended this combination for patients infected with SARS-CoV-2 and, in early February, physicians at the Rajavithi Hospital in Bangkok reported success in treating patients with lopinavir–ritonavir plus the influenza drug oseltamivir. One patient, a 70-year-old woman from Wuhan, reportedly tested negative for the virus after 48 hours on the therapy.
Sheahan says there is precedent for using HIV antivirals to treat coronavirus. In a retrospective study from 2003, patients with SARS who received lopinavir–ritonavir were more likely to survive infection or avoid advanced disease.
However, Sheahan says he would be surprised if HIV antivirals have a big benefit against SARS-CoV-2. He argues that their design is tailored specifically to block the activity of HIV proteases to avoid off-target effects on human cells, which makes them less likely to bind coronavirus proteases as well. “You may need to use drug at levels that are never achievable in a person,” Sheahan says. “It’s unrealistic.”
“This happened for SARS, where clinicians were giving any approved drug that they could to try to improve a patient outcome or save their lives,” he says.
There are at least three registered randomized clinical trial testing the lopinavir–ritonavir combination in Chinese patients infected with SARS-CoV-2 (NCT04255017, NCT04252885 and NCT04251871). A handful of other HIV antivirals are currently in clinical testing against SARS-CoV-2, including darunavir–cobicistat, donated by the US pharmaceutical company Johnson & Johnson to the Shanghai Public Health Clinical Center.
SARS-CoV-2 does have its own proteases, including its main protease, Mpro, which shares features with proteases found in enteroviruses, such as norovirus. A team from ShanghaiTech University compared Mpro’s structural analysis against a worldwide protein databank and found 30 small molecules known to inhibit similar structures. Researchers at the Chinese Academy of Sciences are screening these drugs for antiviral activity in cells.
Sheahan’s team is testing another class of drugs against 2019nCoV: nucleoside analogs, including one nucleoside analog from Drug Innovation Ventures at Emory University in Atlanta, Georgia, and another called remdesivir, an experimental Ebola therapy made by Gilead Sciences in Foster City, California. Remdesivir was used to treat the first US patient infected with SARS-CoV-2, who recovered, and is in phase 3 trials in Wuhan patients infected with SARS-CoV-2, overseen by the China-Japan Friendship Hospital in Beijing (NCT04252664 and NCT04257656).
How can we develop a vaccine within 3 months?
Several MERS vaccines were already in clinical trials when word of the new outbreak spread.
Moderna, based in Cambridge, Massachusetts, has already created an mRNA vaccine against SARS-CoV-2 that encodes a version of the viral spike protein designed by Kizzmekia Corbett, a virologist on Graham’s team at the Vaccine Research Center.
The spike protein shape is pliable and, as it interacts with ACE-2, the areas of the protein most important for that interaction can become hidden from the immune system. Corbett made mutations to the spike-encoding gene so that the protein it encodes stays in a stable, ‘open’ form.
In animal studies, the stabilized form of the MERS spike protein elicits a stronger immune reaction than does the native form. Corbett says she will have the initial data on the mouse immune response to SARS-CoV-2 stabilized spike protein around the end of March.
With financial support from the Coalition for Epidemic Preparedness Innovations (CEPI), Moderna has begun producing their vaccine according to good manufacturing practices, and a phase 1 study should start in April.
CEPI is funding another mRNA vaccine made by Curevac, in Tubingen, Germany; a DNA vaccine made by Inovio Pharmaceuticals in Plymouth Meeting, Pennsylvania; and a protein vaccine developed by a group at the University of Queensland in Australia. Seeking to diversify their collection of vaccine options even further, CEPI released a call for applications that remains open until mid-February.
Laurent Humeau, Inovio’s chief scientific officer, says multiple players will have to be involved to meet the demand. “I don’t think there is one that will cover the millions of doses that are requested.”
Some groups and companies have touted their ability to have a vaccine ready for clinical testing in 3 months or less. “Despite all the claims about how quickly you can move RNA and DNA vaccines into getting to licensure, you still need to do the phase 1 safety studies. That’s the bottleneck,” says Peter Hotez, a microbiologist at Baylor College of Medicine in Houston, Texas. From there, phase 2 studies cannot begin without sufficient data on a vaccine’s safety and ability to stimulate immunity in animal models.
Hotez and fellow Baylor microbiologist Maria Bottazzi have submitted a vaccine plan to CEPI that uses the ACE-2-binding region of the SARS-CoV spike protein to elicit immunity. That area of the protein is more than 80% identical between SARS-CoV and SARS-CoV-2, and they have already tested the vaccine in animals and found it is very safe, Bottazzi says.
As vaccine researchers work through that bottleneck, groups like Sheahan’s will continue to study SARS-CoV-2 and test antiviral approaches. “There’s space for all of this to be done concurrently,” he says. “There’s going to be this explosion of information over the next 6 months to 5 years, and we’re going to be in a better place for the next emergence.”
(원문: 여기를 클릭하세요~)
아래는 2021년 5월 21일 뉴스입니다~
(원문: 여기를 클릭하세요~)
얽히고설킨 mRNA백신 특허…지재권 면제 발목
현재 100개의 백신이 임상시험에 돌입해 있다. 184개는 비임상 단계로 개발이 한창이다. 이 가운데에서 mRNA 백신에 관심이 높다. 임상시험에서 탁월한 코로나19 감염 예방 효과를 입증했기 때문이다.
관련해 21일 식품의약품안전처도 모더나 백신의 국내 품목허가를 결정했다. 화이자에 이은 두 번째 mRNA 백신의 국내 도입에 높은 관심이 쏠렸다.
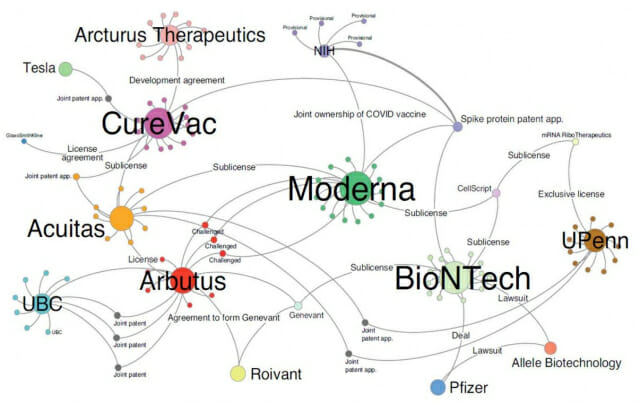
코로나19 mRNA 백신의 특허 관계도. 사진=네이처 바이오테크놀로지 ‘코로나19 mRNA 백신 특허 관계도 분석’(A network analysis of COVID-19 mRNA vaccine patents
백신 제조 방법은 특허로 등록돼 보호된다. 관련 지재권도 다양하다. mRNA 백신을 비롯해 바이오의약품의 개발은 대학 연구진 및 바이오 벤처기업의 자체 개발 기초 기술에서 시작된다. 개발 정보에 대한 특허 등록 이후 다국적 제약사 등 대형기업에 기술이전을 통해 추가 개발 및 상업화 진행이 일반적이다.
우리에게 알려진 모더나·화이자·바이오엔테크·큐어백·아크투루스 등도 mRNA를 활용한 백신 기술 개발사다.
그런데 원천 기술을 거슬러 올라가면 상황은 또 달라진다. 논문에 따르면, mRNA를 활용한 치료법은 1990년대 초 처음으로 개발됐다. 이후 2005년 미국 펜실베이니아대학 연구진이 현재 mRNA 백신 기술의 근간이 되는 연구 논문을 발표했다.
대학은 해당 특허의 실시권을 ‘mRNA 리보 테라퓨틱스’(RiboTherapeutics)라는 업체에 전달했고, 회사는 계열사인 셀스크립트(Cellscript)에 특허 재실시권을 줬다. 셀스크립트는 이를 다시 모더나와 바이오엔테크에 이전했다.
mRNA를 세포로 전달하는데 활용되는 지질나노입자(LNP)의 특허도 복잡하긴 마찬가지다. 해당 기술은 1998년 브리티시콜롬비아대학과 아버터스 바이오파마(Arbutus Biopharma)의 공동 연구로 개발됐다. 이후 대학은 특허권을 아버터스에 이전했다.
2012년 아버터스는 아퀴타스 테라퓨틱스(Acuitas Therapeutics)에 기술 실시권을 전달했다. 아퀴타스는 2016년 큐어백과 LNP 기술 특허를 실시할 수 있는 계약을 체결했다. 아퀴타스는 모더나에게도 특허 재실시권을 줬는데, 이 때문에 분쟁이 벌어졌다.
같은 해 재실시권에 대해 캐나다 법정에서 분쟁이 이어졌고, 결국 기결됐다. 모더나는 2018년 아버터스의 특허 세 건에 대해 미국 특허청(USPTO)에 특허 무효 소송(IPR)을 청구했지만, 특허심판과 항소위원회는 아버터스의 손을 들어줬다.
이후 제네반트가 LNP 기술의 특허 실시권에 접근, 제네반트는 이를 다시 바이오엔테크에 재실시권을 허락했다. 이런 과정을 거쳐 바이오엔테크와 화이자가 코로나19 백신을 개발하게 된 것이다.
지재권을 일시 유예하거나 면제하자는 주장이 나온 이유는 개발도상국 등 예방접종이 원활하지 않은 국가와 지역에 기업이 보유한 mRNA 특허·영업비밀·노하우 등을 공유, 백신 자급력을 높여 접근권을 보장하자는 취지에서다.
결국 논문의 지적처럼 꼬인 특허가 정리되지 않으면 바이든 대통령의 지재권 면제 지지 발언은 그저 정치적 코멘트로 그칠 가능성이 높다는 이야기다.
아래는 2021년 6월 3일 뉴스입니다~
(원문: 여기를 클릭하세요~)
화이자·모더나 백신 부작용의 핵심은 ‘LNP’
LNP 활용 mRNA 연구.. 타 질병 백신 개발

코로나19는 메신저 리보핵산(mRNA) 백신의 포문을 열었다. 미국 제약사 모더나와 화이자의 mRNA 백신이 미국 식품의약국(FDA)의 승인을 받아 세계 최초로 상용화되면서다. mRNA 백신은 기존 백신과 비교해 안전성과 신속성 측면에서 우수한 것으로 알려져있다.
하지만 일각에서는 mRNA 백신 부작용 사례가 잇따라 나오면서 위험성 문제도 제기되고 있다. 반면 mRNA 백신이 향후 코로나 백신 외에 다른 질병의 백신으로까지 개발이 확대될 것으로 보는 의견도 있다.
안전성과 신속성 갖춘 mRNA 백신
mRNA 백신은 바이러스 항원 유전자를 mRNA 형태로 주입해 면역반응을 일으키는 방식이다. 기존 백신과 비교했을 때 안전성과 신속성 측면에서 장점이 있다. 우선 백신의 전달체로 사용되는 mRNA는 우리 몸에 있는 mRNA를 모방해 만들었기 때문에 독성이 없다. 또 질병을 일으키는 병원체의 유전자 정보만 알면 빠르게 백신을 설계, 생산할 수 있다. 따라서 코로나19 변이 바이러스에도 빠르게 대응할 수 있다.
이런 장점에도 불구하고 mRNA 백신 연구는 꽤 오랫동안 주목받지 못했다. 기술의 부족으로 백신을 상용화하는 데 한계가 있었던 탓이다. mRNA 백신의 가능성을 확인한 것은 1990년대다. 체내로 주입한 mRNA가 세포 내에서 단백질을 만들 수 있다는 것이 밝혀지면서다. mRNA 백신이 관심받기 시작한 것은 불과 2~3년 전부터다.
잇따라 나오는 mRNA 부작용 사례
하지만 mRNA 방식을 사용한 모더나와 화이자 백신 접종률이 높아지면서 부작용에 대한 관심도 커지고 있다. mRNA 백신의 대표 부작용은 ‘아나필락시스’ 반응이다. 아나필락시스는 백신 접종 후 발진이나 급격한 혈압 저하, 호흡 곤란 등의 증상이 나타나는 것을 말한다. 증상이 심하면 사망에도 이를 수 있다.
미국 질병통제예방센터(CDC)가 발표한 화이자 1차 접종자들의 부작용 사례를 보면 10만명에 1.1명꼴로 아나필락시스 사례가 나타났다. 독감 백신 접종에서 아나필락시스가 100만명에 1명 정도로 나타나는 것과 비교하면 10배 높은 수치다.

제약바이오 전문가들은 mRNA 부작용 위험성이 나오는 이유로 ‘지질나노입자(Lipid nano particle, LNP)’를 꼽는다. LNP 속 폴리에틸렌 글리콜(Polyethylene glycol, PEG) 성분이 아나필락시스 반응을 일으킬 수 있다는 지적이다.
지난달 27일 최종현학술원이 주최한 ‘백신 위기, 어떻게 극복할까?’ 웨비나에서 이혁진 이화여대 약학과 교수는 “mRNA 백신에 포함된 PEG 성분이 PEG 항체를 일으킬 수 있다는 연구가 계속 나오고 있다”며 “mRNA 백신에서 PEG를 대체하려는 연구가 활발하게 진행 중”이라고 밝혔다.
LNP, mRNA 부작용의 핵심 열쇠
mRNA 백신을 통해 mRNA가 세포 안에 있는 세포질에 도달하면 단백질이 생성된다. 하지만 mRNA가 세포 안으로 들어가는 과정은 쉽지 않다. mRNA 분자가 불안정한 분자이고 세포의 크기가 커서 세포막을 통과하기 어렵기 때문이다. 게다가 mRNA 분자는 인체 내 효소에 의해 쉽게 분해된다. 그래서 mRNA를 안정적으로 세포 내부로 전달하는 것이 백신 연구의 숙원이었다.
LNP는 mRNA가 세포 안으로 전달될 수 있도록 도와주는 역할을 한다. LNP는 일종의 작은 지방 덩어리다. mRNA를 LNP로 감싸 보호하는 단백질 발현을 돕는다.

LNP는 크게 △이온화지질 △콜레스테롤 △폴리에틸렌 글리콜(PEG)로 구성돼 있다. 이온화지질은 mRNA가 세포를 둘러싸고 있는 세포막을 쉽게 통과하도록 돕는다. 콜레스테롤은 mRNA 분자의 모양을 유지하면서 세포질로 전달하는 역할을 담당한다. PEG는 세포 내로 전달된 LNP가 몸속에 오랫동안 머물 수 있게 해준다.
문제는 PEG 성분이 부작용을 유발할 수도 있다는 연구 결과가 잇따라 나오고 있다는 점이다. 국제학술지 사이언스는 “화이자와 모더나 백신에 포함된 PEG 성분이 알러지 반응을 일으킬 수 있다는 의혹이 커지고 있다”고 발표했다. PEG 항체 수치가 높아지면 백신 접종 후 아나필락시스 반응이 나타날 수 있다는 설명이다.
반면 mRNA 백신의 부작용과 PEG 관련성이 적다고 보는 시각도 있다. 백신에 포함된 PEG 함량이 부작용을 일으키기엔 너무 적은 양이라는 의견이다. 코로나 mRNA 백신에서 LNP를 만들 때 들어가는 PEG 함량은 1% 내외다. 모더나의 경우 10μg(마이크로그램), 화이자는 3μg 정도다.
코로나 끝나도 mRNA 연구는 계속
mRNA 백신의 안전성 의혹에도 향후 암 예방 백신 등 여러 분야에서 mRNA 연구개발은 더욱 활발하게 진행될 것으로 전망된다. 이미 국내에서도 mRNA 백신 연구개발이 진행 중이다.
동아쏘시오홀딩스 자회사인 에스티팜은 지난 1일 국내 최초로 LNP 방식을 적용한 코로나 mRNA 백신 개발에 본격적으로 나선다고 밝혔다. 앞서 에스티팜은 스위스의 제네반트 사이언스로부터 코로나 mRNA 백신 개발에 필요한 LNP 기술 도입에 관한 비독점적 라이선스 계약을 체결한 바 있다.
김빛내리 서울대 생명과학부 석좌교수는 “코로나 백신에 이어 향후에는 암이나 유전성 대사질환 등에 RNA 치료학이 매우 중요한 역할을 할 것”이라고 강조했다.
아래는 2021년 8월 16일 뉴스입니다~
(원문: 여기를 클릭하세요~)
mRNA 곳곳 ‘특허’ 지뢰밭…회피 묘수 ‘골몰’
■ mRNA, 다국적 제약사의 ‘총성없는 전쟁터’
미국 제약업체 화이자와 모더나가 최근 유럽연합(EU)에 공급하는 코로나19 백신 가격을 인상했다.
미국과 WHO(세계보건기구) 등이 코로나19 백신의 지재권 면제를 추진해왔지만, 백신 제조사들을 수익 감소 등을 이유로 적극 반대해왔다.
최근 델타 변이 코로나 바이러스까지 확산되면서 추가 접종(부스터 샷)에 필요한 백신 추가 확보도 예상됨에 따라 화이자와 모더나 mRNA 백신의 몸값은 더욱 높아질 전망이다.
때문에 글로벌 제약기업들은 서둘러 mRNA백신 개발에 나섰지만 쉽지 않은 상황이다.
mRNA 백신은 관련 특허만 300가지 이상으로 백신 개발에 성공했다고 하더라도 특허 회피를 해야 하는 문제가 있다.
그래서 백신 개발보다는 원천기술을 보유한 기업 인수를 통해 시장에 발을 들인다.
실제로 프랑스 제약기업 사노피는 코로나19 mRNA 백신을 공동 개발하던 기업 인수에 나섰다.
사노피는 미국의 mRNA 기업인 트랜스레이트 바이오를 32억 달러(한화 약 3조6,800억원)에 인수하기로 했다.
사노피는 글로벌 백신 선두기업이지만 코로나19 백신 개발에선 화이자, 아스트라제네카, 얀센, 모더나 등에 속도가 밀렸다.
이번 인수로 사노피는 mRNA 백신 개발에 집중할 것으로 보인다.
시장조사기관 글로벌 인더스트리 아날리스트(GIA)에 따르면 올해 mRNA 백신 시장 규모는 640억 달러(한화 약 72조원)에 이를 것으로 전망되고 있다.
연평균 11.9% 증가해 2027년에는 1270억 달러(약 144조원)에 이를 것으로 보인다.
■ 얽히고 설킨 ‘mRNA백신’ 특허…향후 개발에 있어 걸림돌 될수도
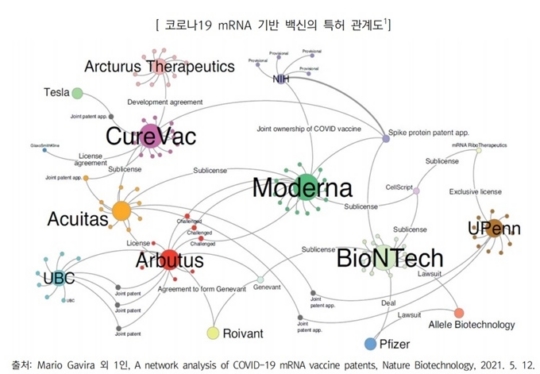
(사진=한국바이오협회)
그렇다면 mRNA백신을 왜 개발을 하기 힘든 것일까.
현재 급속도로 관심을 받고 있는 ‘mRNA 백신’의 경우 굉장히 첨예한 특허 관계가 얽혀있다.
한국바이오협회의 ‘코로나19 mRNA 백신에 얽힌 복잡한 특허 관계’ 보고서에 따르면, 개발 중인 코로나19 백신의 형태는 바이러스 벡터 기반, 단백질 기반, mRNA 및 지질나노입자(LNP) 등에 이르기까지 다양하다.
백신 개발 기술은 ‘특허’로, 제조 방법과 기법(노하우)는 ‘영업 비밀’로 보호될 수 있다. 이에 백신 개발에는 여러 종류의 지식재산권이 관여돼 있다.
mRNA 백신을 포함해 바이오의약품은 기본적으로 대학이나 스타트업에서 개발된 기초 기술이 특허로 보호된다.
그리고 추가 개발 및 상업화를 위해 큰 기업으로 기술 이전이 이뤄진다.
현재 상용화된 mRNA 백신의 핵심 기술이자 특허는 두 가지다.
백신을 감싸는 ‘겉’ 물질인 지질나노입자(LNP), mRNA ‘안’을 설계하는 메틸수도유리딘이다.
화이자와 모더나는 두 기술 모두 원천 특허기업으로부터 들여왔다.
결국 mRNA 백신을 자체 개발하기 위해서는 mRNA 설계 및 제조 기술은 물론 지질나노입자(LNP) 기술을 확보하는 것이 관건이다.
좀 더 자세히 살펴보면 mRNA 백신 ‘안’을 제조하는 데 필요한 원천 특허를 셀스크립트가 보유하고 있다.
바이오업계 관계자는 “결국 셀스크립트 특허 확보를 못하면 빠른 시간 내에 백신 개발을 할 수 없다고 본다”고 말했다.
그 다음 중요한 것이 mRNA 백신 개발의 핵심으로 꼽히는 지질나노입자(LNP) 기술이다.
mRNA는 핵 안에 있는 DNA의 유전정보를 해독해 세포질 안의 리보솜에 전달하는 핵산으로 온도·화학물질 등 외부 환경에 매우 취약한 특징을 갖는다.
특히 체내에는 수많은 RNA 분해효소가 있어 쉽게 변형·분해될 수 있다.
LNP 플랫폼 기술은 mRNA 등 유전자 물질을 지질 나노 입자로 감싸 생체 내에 안정적으로 도달할 수 있게 돕는 ‘약물 전달체’ 역할을 한다.
미국 ‘아뷰투스’와 영국 ‘제네반트’ 등이 사실상 독점하고 있는 LNP 제조기술 특허를 회피할 수 있는 전략을 모색하기 위한 특허 연구가 필요하다.
mRNA 백신의 경우 원천기술이 필요한 분야일뿐 만 아니라 관련 특허만도 수백가지에 이르기 때문이다.
■ mRNA 기반 백신 개발 국내사, 자체 원천기술개발…화이자·모더나 넘는다
글로벌 제약사들이 mRNA백신 개발에 열을 올리는 사이 국내사들도 후발주자지만 시장에 뛰어들었다.
하지만 국내사들도 mRNA백신의 복잡한 특허를 피해갈 수는 없는 상황이다.
이들의 과제는 LNP와 셀스크립트 등 mRNA 백신에 광범위하게 설정된 특허를 피해가거나 또다른 원천기술을 확보하는 것이다.
큐라티스는 국내 최초로 식품의약품안전처로부터 mRNA 코로나 백신 임상1상을 승인받았다.
큐라티스가 개발중인 mRNA 기반 코로나 백신 후보물질은 ‘QTP104’이다.
이는 코로나바이러스의 스파이크 단백질을 코딩하는 self-replicating(자기복제) mRNA라고 할 수 있다.
쉽게 말해 기존의 mRNA 백신의 앞에 복제를 할 수 있는 것을 붙인 것으로 repRNA라고 한다.
한 마디로 차세대 mRNA 백신인 것이다.
repRNA는 세포 내로 들어가서 자기 복제를 하게 되는데 훨씬 적은 양으로 동일한 효과를 얻게 되는 것이다.
예를 들어 모더나 백신은 약효를 위해서 100㎍ mRNA 투여량이 필요한 반면 큐라티스의 repRNA는 5배에서 50배 정도 적게 투여해도 비슷한 수준의 항원을 생산할 수 있게 된다.
특히 mRNA백신 중요 특허 확보와 관련해 조관구 큐라티스 대표는 “LIONs(Lipid Inorganic Nanoparticles, 지질 무기질 나노 입자)라는 형태인 LNP 물질을 별도로 특허까지 보유하고 있다”며 “한 단계 더 진보된 LNP 물질이며, 기존 제조기술에 문제가 되지 않는다”고 말했다.
또 “repRNA는 말 그대로 세포 내 존재하는 유리딘을 이용해 mRNA를 증폭한다”며 “이렇게 자연산 유리딘으로 만들어진 mRNA가 단백질 생성을 유도하기 때문에 메틸수도유리딘 사용이 필요없다”고 강조했다.
큐라티스는 mRNA 백신 개발에 중요한 특허를 모두 확보한 셈이다.
코스닥 상장사 올릭스 자회사 엠큐렉스는 중요한 mRNA 백신 관련 원천 특허인 분자구조 설계 기술을 국내 최초이자 유일하게 확보했다.
엠큐렉스는 mRNA 백신의 핵심 기술이자 두가지 특허 중 하나인 메틸수도유리딘에 대한 회피 기술 확보에 성공했다.
다만 특허를 등록하면 기술이 공개되기 때문에 엠큐렉스는 당분간 극비로 진행할 계획이다.
아이진은 백신 후보물질 ‘EG-COVID’에 대한 국내 임상 1·2a상 시험계획을 제출하고 승인을 기다리고 있는 상황입니다.
아이진 측은 mRNA 플랫폼만 같은 뿐 화이자, 모더나와 다른 전달체를 사용하고 있다.
모더나, 화이자 등은 감염병 예방 목적이 아닌 항암백신으로 mRNA 플랫폼 기술을 개발했으며, 약물 전달체로 지질나노입자(LNP)를 사용하는데, LNP에는 폴리에틸렌글라이콜(PEG) 성분이 포함돼 있어 낮은 확률이라도 전신 알레르기반응인 아나필락시스 가능성을 배제할 수 없기 때문이다.
화이자와 모더나가 mRNA 전달체로 ‘LNP(지방 나노입자)’를 사용하고, 아이진은 ‘양이온성 리포솜’을 쓴다.
화이자와 모더나가 LNP로 RNA를 감싸서 안정적으로 이동할 수 있게 한다면, 아이진은 양이온성 리포솜은 RNA가 가진 음(-)의 성질을 이용해 mRNA와 결합이 잘되도록 했다.
LNP는 항암제 등에 사용되는 PEG(폴리에틸렌 글라이코)를 이용해 만드는데, 이 물질은 인체에 주입 된 물질이 인체에 오래 남아있을 수 있게 도와주는 역할을 한다.
원래 mRNA백신은 암 치료의 목적으로 개발됐기 때문에 오래 신체에 남아 작용해야 유리하기 때문에 이 물질을 사용해 왔다.
그런데 최근 이 물질이 화이자나 모더나 백신의 드물게 나타나는 아나필락시스(알레르기 반응)의 원인으로도 추정된다.
반대로 리포좀을 사용한 백신은 주사 부위에만 물질이 남는다.
LNP를 사용하려면 영하 20~70℃에서 보관해야 하지만, 리포좀은 동결건조를 할 수 있어 영상 2~8℃, 최대 29개월까지 보관할 수 있다.
아이진은 양이온성 리포좀 특허를 갖고 있다.

셀트리온은 가장 먼저 mRNA 백신 관련 기술을 가지고 있는 미국 기업과의 기술제휴를 택했다.
셀트리온은 지난 4일 미국 트라이링크 바이오테크놀로지(이하 트라이링크)사와 계약을 체결하고 차세대 mRNA 백신 플랫폼 개발에 착수했다고 밝혔다.
트라이링크는 미국 샌디에이고에 위치한 mRNA 플랫폼 기반 위탁개발 및 생산업체(CDMO)다.
mRNA 백신 개발에 필수적인 고유의 백터 및 3세대 캐핑 기술(클린캡, CleanCap)을 보유하고 있으며, 임상물질과 함께 기술이전을 제공할 수 있는 역량을 갖춘 회사다.
트라이링크는 항원 서열 검증과 함께 독자적인 캐핑 기술 등을 활용해 셀트리온에 임상1상과 2상을 진행할 수 있는 물질을 생산해 공급할 예정이다.
또, 트라이링크는 GMP 생산이 가능한 주형 벡터 및 mRNA 공정 기술을 셀트리온에 제공한다. 셀트리온은 이를 활용해 차세대 백신을 독자적으로 개발한다.
셀트리온 관계자는 “아직 mRNA 백신 개발과 관련해 초기 단계지만 향후 특허를 회피한 벡터 개발과 함께 핵산 및 캐핑 개량 연구를 통해 원천기술을 확보하고 mRNA 공정 설비 구축을 통해 대규모 임상3상 물질 생산을 자체적으로 진행할 계획이다”고 말했다.
mRNA 백신 개발 국내사 관계자들은 아직은 초기단계지만 향후 안정적인 개발을 위해선 정부의 적극적인 지원이 무엇보다 필요하다고 입을 모았다.
바이오업계 관계자는 “정부가 mRNA 백신을 먼저 개발한 화이자·바이오엔테크, 모더나의 촘촘한 특허를 회피할 수 있는 전략과 mRNA 설계·전달체·생산·전임상 등 전주기를 지원해주는 전략이 필요하다”고 말했다.
특히 “화이자나 모더나가 출원한 mRNA 백신 관련 특허 맵을 분석하고 이를 회피하는 전략이 mRNA 백신 플랫폼 국산화의 관건”이라며 “결국 특허와 관련해 특허청과의 긴밀한 협력이 필요하다고 덧붙였다.
특히 특허 관련 지원도 중요하지만 궁극적으로 백신개발을 위해 반드시 필요한 임상인원 확보도 정부의 지원이 필요하다고 이야기했다..
또 다른 바이오업계 관계자는 “3만명의 임상실험을 하려면 검사비와 참여비 등 천문학적인 비용이 필요하다”며 “이를 민간기업 차원에서 해결하기는 어렵고 정부의 재정적인 지원이 절실한 부분”이라고 말했다.
이어 “최근 백신을 접종률이 높아지고 있는 상황에서 정상적인 임상시험은 어렵다”며 “비교임상에서도 4000명의 피험자가 필요하고 이중 10%를 국내에서 모집할 것으로 알고 있는데 나머지 해외에서 피험자 모집시 전폭적인 지원이 필요하다”고 덧붙였다.
■ 정부가 직접 나선다…특허 심사 기간, ‘2개월’로 대폭 줄어

정부도 mRNA 백신의 중요성을 인지하고 국내 기업들이 신속하게 mRNA 백신 기술을 확보해 해외와의 기술 격차를 줄여나가도록 범부처 차원에서 지원하겠다고 밝혔다.
우선 정부는 특허청을 중심으로 특허회피전략을 짜고 있다.
특허청은 지난달 23일부터 코로나19 백신을 개발하거나 생산하는 기업이 출원하는 특허는 우선 심사하는 제도를 시행 중이다.
이 제도를 활용하면 평균 14개월이 걸리던 특허 심사 기간이 2개월로 대폭 줄어든다.
또 최적 기술보호 가이드라인을 제공해 분쟁 위험 사전 진단 및 무효·회피 등 기업의 분쟁 대응 전략도 지원한다.
권덕철 보건복지부 장관은 지난 5일 ‘K-글로벌 백신 허브화 비전 및 전략보고대회’ 관련 브리핑에서 “mRNA 백신 개발을 위해서는 원천기술이 필요하다”며 “특히 해외기업의 특허를 피하면서 독자기술개발을 위해 특허청 중심으로 적극지원하고 있다”고 설명했다.
이강호 복지부 글로벌백신허브화추진단장도 “특허청에서 지난달 mRNA백신과 관련한 개략적 분석을 통해 200여개의 기관을 대상으로 특허설명회를 했다”며 “특허분석과 회피전략을 동시에 마련해 연구단계부터 기존 특허를 회피할 수 있는 연구를 할 수 있도록 지원할 계획”이라고 말했다.
■ 왜 mRNA인가?…RNA, 새로운 유전자 치료제로 가능
mRNA 연구 개발은 더 큰 카테고리인 RNA와 연관이 있다.
개인마다 다른, 고유의 유전 정보와 필요한 단백질 정보를 가지고 있는 DNA를 복사해 단백질을 만드는 기관에 전달하는 것이 RNA고 DNA의 설계도면을 공장에 전달하는 역할을 담당하는 것이 바로 mRNA다.
기초과학연구원에 따르면 RNA의 다양한 능력은 ‘생명현상의 조절자’라고 요약할 수 있다.
현재 DNA와 단백질이 담당하는 기능이 RNA에 여전히 남아 있다.
따라서 생명의 기원이 되는 지구 역사상 첫 유전물질이 DNA보다 RNA일 가능성이 크다고 추정하는 과학자들도 많다.
생명현상 유지에 필요한 유전과 효소 기능의 대부분을 DNA와 단백질에 넘기고 RNA는 조절작용에 집중하고 있는 셈이다.
이런 기능의 중요성 때문에 RNA는 코로나19 뿐 아니라 다음의 또다른 펜데믹, 그리고 나아가 새로운 유전자 치료제로 확장될 가능성이 있는 것으로 밝혀졌다.
실제 바이오제약업계 연구자들은 RNA의 새로운 성질과 기능을 찾아내면서, 기존 패러다임을 바꿀 강력한 치료제 후보가 될 것이라 기대한다.
RNA는 인공적인 합성과 설계가 비교적 용이하지만, 불안정하다는 약점만 해결한다면 약물이나 백신으로 개발하기 쉽다.
그래서 앞으로 더욱 다양한 약물과 백신 개발에 대한 후속연구들이 이어질 것으로 기대되며, 암도 RNA에서 치료의 희망을 찾을 수 있다는 것이다.
또한 진단 기술도 한 단계 끌어올릴 수 있을 것으로 기대된다.
진단은 대부분 환자의 증상이나 조직 변화를 기반으로 이뤄진다.
만약 세포 수준에서 진단할 수 있다면 빠르게 병의 발생을 확인할 수 있다.
바이오제약업계 관계자는 “세포는 저마다 특이한 RNA를 생성하는데, 어떤 RNA가 얼마나 발생하는지 알 수 있다면 세포 상태를 확인할 수 있다”고 있다고 말했다.
또 “미래에는 RNA 진단을 통해 암의 징후나 그밖의 불치병에 대해서도 미리 포착할 수 있을 것으로 보인다”고 덧붙였다,
아래는 2022년 3월 11일 뉴스입니다~
(원문: 여기를 클릭하세요~)
코로나 백신은 왜 부작용이 강한가
백신에 대한 오해와 진실 (중)
RNA 통해 세포에 항원 정보 전달
간단하고 확실한 면역 수단이지만
발현 효율 높은 만큼 부작용 세고
온몸에서 발생해 위치 예측 어려워
세계보건기구로부터 승인을 받은 코로나19 백신들. 위키미디어 코먼스
이전 칼럼에서 오미크론에 의해 백신의 집단면역이 뚫리게 된 이유와 그럼에도 백신의 개인 보호가 여전히 유효한 이유를 설명하였다. 이번에는 백신의 면역학적 원리와 다양한 백신, 특히 RNA 백신의 장단점에 대해 알아보자.
먼저 백신의 작동 배경인 면역 체계를 간단히 정리하자.
면역은 크게 선천면역과 적응면역으로 나뉘며, 적응면역은 다시 체액면역과 세포매개면역으로 구분된다(그림1).
기본적인 면역 기능은 유전자에 각인되어 있어 선천면역이라 한다. 적응면역은 레고 블록처럼 단위 유전자를 재조합하여 항원에 결합하는 항체와 세포매개면역 수용체를 골라낸다. 항원에 고유한 재조합 정보는 유전자에 포함되어 있지 않고, 살아가면서 접촉하는 항원에 맞춰 그때그때 선택되기에 적응면역이라 한다. 이 두 면역은 다른 진화적 배경을 가지고 있다.
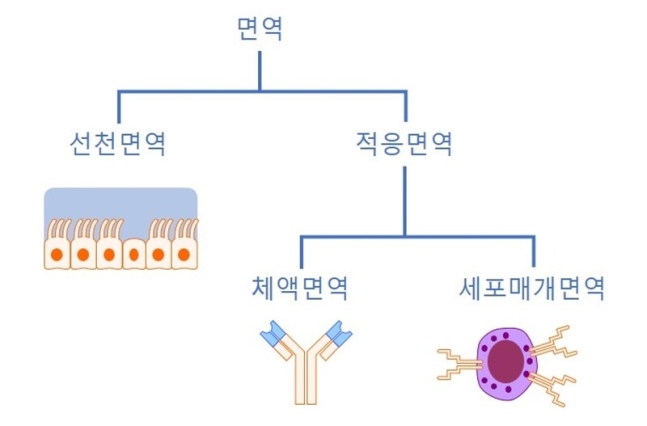
그림1. 면역 체계 (바이러스의 시간, 2021, 뿌리와이파리)
원시적인 선천면역은 바이러스를 정확히 구분하지 못한다. 뭔가 잘못되었다는 대강의 위험만 감지해 염증을 일으킨다. 피아 구분이 없는 염증은 내가 죽든지 바이러스가 없어지든지 사생결단이다. 이에 반해 정밀한 적응면역은 바이러스만 공격한다. 체액면역의 주성분인 항체는 크기가 작아 인체의 구석구석을 돌아다닌다. 그러다 바이러스를 만나면 표면 항원에 결합해 감염 능력을 거세(중화)시킨다. 세포매개면역은 감염 세포를 찾아 죽여 새로운 바이러스가 만들어지지 못하게 막는다. 정교한 적응면역은 준비가 오래 걸린다는 치명적인 약점이 있다. 그래서 적응면역이 발동되기 전까지는 선천면역이 바이러스 확산을 저지한다. 이렇게 각각 임무를 가진 면역 요소들은 서로 긴밀하게 협력하여 바이러스를 완전히 제거한다. 그런데 협력에는 통신 수단이 필요하다. 면역의 통신 수단이 사이토카인이며, 사이토카인 폭풍은 면역 통신이 혼란에 빠진 상황을 말한다.
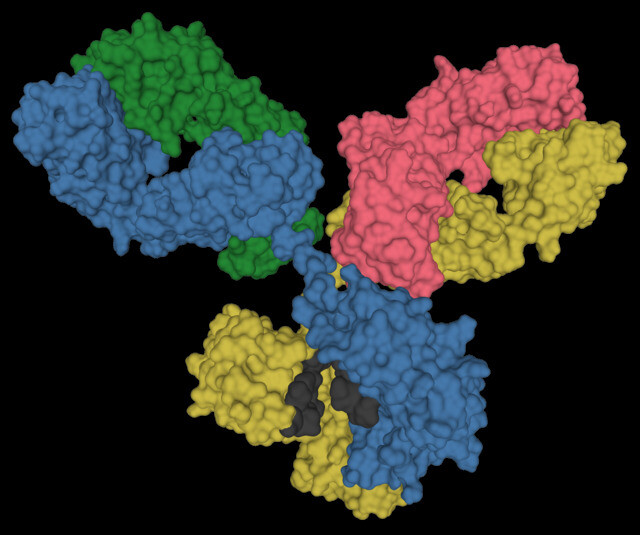
항체는 Y자 모양을 하고 있는 게 특징이다. 위키미디어 코먼스.
선천면역의 염증은 ‘양날의 칼’이다. 적절하면 바이러스 증식을 억제하지만, 과도하면 인체에 큰 피해를 입힌다. 실제 코로나 감염으로 사망하는 직접 사인은 바이러스가 아닌 통제되지 않는 염증이다. 선천면역이 오래 작동할수록 사이토카인 폭풍이 일어날 위험이 커진다. 이렇게 위험한 선천면역을 다시 칼집에 넣는 게 적응면역이다. 적응면역은 선천면역을 억제하기 때문에, 그 개입이 빠를수록 선천면역의 작동이 최소화된다. 즉 바이러스 감염의 결과는 적응면역의 준비 속도에 달려 있다고 할 수 있다. 그런데 처음 접한 바이러스에 대한 준비 시간을 줄일 수는 없다. 하지만 한번 접한 바이러스에 대해서는 빠르게 준비할 수가 있다. 적응면역은 경험한 바이러스에 대한 재조합 정보를 버리지 않고 기억세포로 저장해두기 때문이다. 만약 바이러스가 다시 침입하면 처음부터 준비할 필요 없이 기억세포를 깨워 즉각 개입한다. 한정된 환경에서 한번 접한 바이러스는 계속 접할 가능성이 크기 때문에, 기억세포의 저장은 아주 효과적인 전략이다. 새로운 적응면역의 준비에 대략 2주일이 걸리는데 기억세포부터 시작하면 길어야 이틀이면 준비가 끝난다. 이 면역의 기억을 이용하는 것이 바로 백신이다.
적응면역이라는 측면에서 신종 바이러스란 준비에 시간이 걸린다는 의미다. 특히 코로나19는 적응면역 준비를 늦추는 특별한 능력을 가지고 있어, 감염되면 선천면역이 과도하게 작동될 위험이 더 크다. 우리가 접종한 백신은 이 위험 요소를 제거해준다.
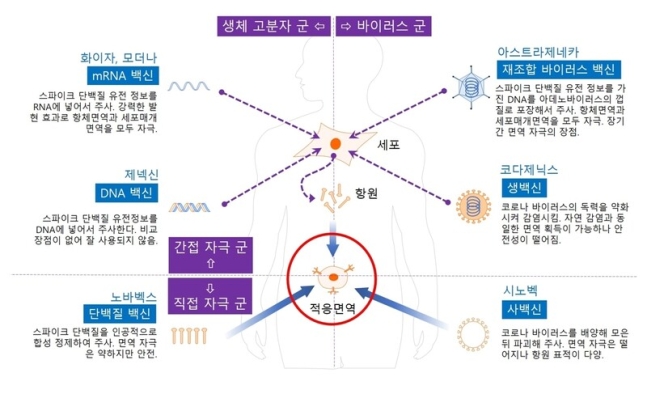
그림2. 다양한 백신 플랫폼(바이러스의 시간, 2021, 뿌리와이파리)
모든 백신의 공통 목표는 코로나에 대한 정보(항원)를 적응면역에 알려줘 미리 준비시키는 것이다. 접종 후 처음 몇 달은 적응면역이 활성화된 완전 준비 태세로 유지되고, 그 이후에는 기억세포가 코로나의 침입을 계속 감시한다. 백신들은 이 목표를 달성하기 위해 여러 가지 방법(플랫폼)으로 항원을 전달한다(그림 2). 가운데 빨간 동그라미의 적응면역을 중심으로 위쪽은 간접, 아래는 직접 항원을 전달해 적응면역을 자극한다. 그리고 항원 또는 그 정보를 담은 그릇에 따라 오른쪽은 바이러스, 왼쪽은 생체고분자로 구분된다. 우리가 접하는 백신의 효능과 부작용은 이 분류에 의해 결정된다.
우선 오른쪽 아래의 사백신과 생백신을 살펴보자. 이 고전적 플랫폼들의 비교는 직-간접 자극의 장단점을 이해하도록 도와준다. 단어만 보면 생백신은 살아있는, 사백신은 죽어있는 바이러스를 의미한다. 하지만 무생물 상태인 바이러스 입자에 대한 생사 구분은 무의미하다. 정확히 생백신은 감염과 증식을 할 수 있는 온전한 바이러스, 사백신은 감염 자체가 불가능한 바이러스의 찌꺼기다. 생백신은 독성을 약하게 조작한 바이러스다. 실제 자연 감염과 동일한 경과를 거치기 때문에 면역 자극이 확실하지만 그만큼 위험하다. 더구나 코로나처럼 변이가 빈번한 경우는 다시 독성을 회복할 위험도 있어 상용화가 어렵다. 이를 간접 자극으로 분류하는 이유는 주입한 바이러스가 아니라 감염된 세포에서 새롭게 만들어지는 바이러스 단백질들에 의해 이차적으로 면역이 자극되기 때문이다. 이에 비해 사백신은 주입한 바이러스 찌꺼기가 항원으로 직접 면역을 자극한다. 사백신의 경우 감염이 일어나지 않아 안전한 대신 면역 자극 효과가 떨어진다. 바이러스를 대량으로 배양해 모은 뒤 물리 화학적으로 감염 능력을 파괴해서 만드는데, 기술적 난이도가 높지 않아 가장 빠르게 상용화되었다.
바이러스 전체를 이용하는 고전 백신과 달리, 이번에 새롭게 투입된 백신 플랫폼들은 적응면역을 가장 효과적으로 준비시키는 스파이크 단백질만 항원으로 이용한다. 그리고 항원을 어떤 형태로 전달하는가에 따라 RNA, DNA, 그리고 단백질 백신으로 구분된다. 먼저 대표적인 단백질 백신이 최근에야 상용화 대열에 합류한 노바벡스다. 시험관에서 대량으로 인공 합성하여 정제한 스파이크 단백질이 직접 면역을 직접 자극한다. 하지만 사백신처럼 바이러스 찌꺼기가 무질서하게 엉겨있는 것이 아니라, 코로나19의 표면과 유사하게 스파이크 단백질을 정렬시켜 만든다. 따라서 사백신처럼 안전하면서도 더 효율적으로 적응면역을 자극한다.
스파이크 단백질 정보를 가진 DNA나 RNA를 주입하는 것은 항원을 간접적으로 전달하는 방법이다. 유전자가 들어가면 세포는 항원(스파이크 단백질)을 일정 기간 발현하여 적응면역을 지속적으로 자극한다. 항원을 접한 적응면역은 바이러스 감염이 일어난 것으로 착각하고 열심히 준비한다. 즉 생백신의 효율과 사백신의 안전성이 절충되는 것이다. 그럼 스파이크 단백질을 발현하는 세포의 운명은 어떻게 될까. 준비가 끝난 적응면역이 제거한다. 무섭게 들리지만 이렇게 죽는 세포 수는 매일 만들어지는 세포 수에 비하면 미미한 수준이다.
원리는 이처럼 간단하지만 문제는 DNA나 RNA를 우리 몸의 세포 속으로 전달하는 것이다. 세포를 감싼 세포막이 DNA나 RNA를 튕겨낸다. 이를 해결하기 위해 먼저 나온 것이 아스트라제네카의 재조합 바이러스 백신이다. 이는 스파이크 정보가 담긴 DNA를 아데노바이러스의 껍데기에 넣어서 만든다. 재조합의 의미는 서로 다른 바이러스 껍데기와 유전자를 조합하였다는 것이다. 바이러스 껍데기는 자기 유전자를 숙주 세포 속에 효율적으로 집어넣기 위해 수십억년을 진화한 구조물이라는 점을 이용하는 것이다. 아데노바이러스의 원래 유전자는 모두 삭제되었기에 스파이크 유전자만 배달하고 나면 껍데기는 녹아 사라진다. 즉 껍데기는 일회용 그릇인 셈이다. 이 백신의 단점은 DNA가 세포핵까지 들어가 RNA를 만든 뒤, 단백질이 만들어지는 과정을 거쳐야 해 발현 효율이 떨어진다는 것이다. 대신 적응면역이 준비되어 죽일 때까지 주입된 세포에서 스파이크 단백질을 꾸준히 만든다. 이것은 오미크론에서 특히 중요성이 커진 세포매개면역 자극에 유리하다.
화이자와 바이온테크가 공동개발한 5~11세용 코로나19 RNA백신. 위키미디어 코먼스
이제 유명한 모더나와 화이자의 RNA 백신을 알아보자. 세포핵 속에 안정적으로 보관되는 DNA와 달리, RNA는 유전 정보를 핵에서 세포질로 전달하는 임시 메모와 같은 역할을 한다. DNA 정보를 베껴서 만들어지고, 일정량의 단백질을 만들고 나면 파괴되는 과정이 반복된다. 따라서 세포로 들어간 RNA가 장기적인 문제를 일으킬 가능성은 거의 없다. 또한 핵까지 들어갈 필요가 없이, 세포로 들어가면 바로 단백질이 만들어져 발현 효율이 높다. 이렇게 RNA 백신은 이론적으로는 가장 간단하고 확실한 적응면역 자극 수단이다. 그럼에도 그동안 백신 플랫폼으로 사용되지 못한 것은 안정적으로 보관하기도, 세포 안으로 전달하기도 어려웠기 때문이다. 하지만 최근 유체기술의 발전으로 이런 기술적 난관이 극복되어 상용화되었다.
하지만 이런 장점들은 부작용의 불안 요소이기도 하다. 발현 효율이 높아 면역 자극이 강하기 때문에 예상되는 단기 부작용의 강도도 세다. 또한 전신 세포에서 광범위하게 발현되기 때문에 부작용의 발생 위치를 예측하기도 어렵다. 그래도 이런 단기적 부작용은 인과 추적이 어느 정도는 가능하다. 하지만 문제는 데이터가 없는 장기적 부작용의 가능성이다. 물론 앞서 설명한 대로 RNA 백신의 특성상 장기적 부작용의 발생 가능성은 희박하다. 하지만 다양한 면역학적 배경을 가진 수십억의 사람에게 접종이 이루어진 상황이다. 따라서 아무리 희박한 확률이라도 0이 아닌 이상 예측하지 못한 장기 부작용이 발생할 가능성은 분명히 존재한다.
백신을 둘러싼 논란은 현재의 이득과 미래의 부작용 사이의 갈등이다. 위키미디어 코먼스
백신에 대한 뜨거운 논란은 확실한 현재의 이득과 불확실한 미래의 부작용 사이에서 갈등이라 할 수 있다. 논란을 더욱 복잡하게 만드는 것은 오미크론의 등장이다. 같은 뿌리의 코로나19 변이지만, 집단면역을 유지하는 ‘항체’의 관점에서 오미크론은 이전 코로나19 변이와는 다른 신종 바이러스나 다름없다. 이처럼 어떤 변이가 튀어나올지 예측이 어려울수록 대응의 유연성은 더 중요해진다. 코로나19 방역은 양궁 경기가 아니라 사냥에 가깝다. 고정된 표적이 아니라 야생 동물처럼 멋대로 움직이는 표적(moving target)을 맞춰야 한다. 어제 명중한 조준을 고집하면 오늘은 빗나간다. 또한 오늘 조준이 달라졌다고 어제 조준이 잘못된 것도 아니다.
문제를 간단히 만들기 위해 오미크론 이후 기본과 추가 접종만 생각해보자. 이제 오미크론으로 백신의 집단면역 효과는 기대하기 어렵다. 하지만 기본 접종으로 개인이 얻을 수 있는 이득은 오히려 커졌다. 기존 항체를 회피하는 오미크론은 접종자와 비접종자 구분 없이 퍼진다. 누구라도 감염될 확률이 커진 것이다. 하지만 백신 접종으로 획득한 기억세포는 위험한 선천면역의 진행을 최소화시킨다. 즉 확진자가 폭증할수록 백신으로 인한 부작용보다는 이득을 볼 확률이 커지는 것이다. 하지만 추가 접종에 대해서는 이익과 손해의 균형을 예측할 데이터가 부족하다. 따라서 추가 접종의 경우는 이익과 위험의 균형을 고려해 세분화된 집단별로 원칙이 달라질 것으로 예상된다.
마무리하기 전에 이전 칼럼에 대한 독자의 질문 한 가지를 언급하려 한다. 앞선 칼럼의 ‘근육주사를 통해 주입되는 백신을 통해서는 점막 항체가 분비되지 않는다’는 내용에 대한 반박으로, RNA 백신을 접종한 사람들의 점막에서 스파이크 단백질에 대한 면역글로불린A(IgA)가 검출된 것을 보고한 논문이 있다는 내용이었다. 아래 글은 이에 대한 대답이다. 조금 전문적인 내용이라 일반 독자는 건너뛰어도 상관없다.
우리 면역은 감염 기전을 따라 효율적인 방어가 이루어지도록 진화되었다. 면역은 많은 생체 자원을 소모하는 일이기 때문에, 효율적 방어를 위해 감염이 일어난 곳에 면역 자원을 집중시키도록 작동한다. 점막에는 외부 환경에 존재하는 항원을 전문적으로 채집하는 M 세포가 존재하며, 선천면역이 유발하는 염증은 인근 혈관의 단백질 발현과 물리적 구조를 변화시켜 전신을 순환하던 면역세포들이 감염부위로 모이도록 한다. 적응면역이 완료되어 분화가 끝난 형질세포도 이를 통해 감염이 일어난 점막의 바로 아래에 유도(homing)된다. 이 형질세포는 점막 환경에서 제대로 작동하기 위한 특별한 구조의 IgA를 분비한다. 그럼 호흡기 상피세포는 분비된 항체를 포집해 안정화 단백질을 추가하는 처리를 한 뒤 점막 즉 외부로 sIgA를 분비한다. 이 sIgA가 바이러스를 전문적으로 중화하는 항체이다. 작년 근육주사를 통해서도 점막에 IgA가 검출된다는 논문이 3개가 나왔는데, 이 현상은 RNA 백신에 의해서만 관찰되고 사백신에서는 일어나지 않았다. 그런데 얼마 전 이 항체들은 제대로 된 중화효과를 가지기 어렵다는 논문이 나왔다. 이 논문의 해석은 다음과 같다. 이 항체들은 점막에 분비(secretion)된 것이 아니라 누출(exudation)된 것이며, IgA로 클래스 변환이 일어난 것은 광범위한 RNA 백신의 분포로 인해 장점막하에서 스파이크를 발현시켰기 때문일 것이다. 누출의 근거로는 IgA가 이량체가 아닌 단량체이고 해당 샘플에는 IgA보다 더 많은 IgG가 존재한다는 점, 혈액 내 항체 농도와 비례해 사라진다는 점 등이다. 누출의 원인으로는 혈관 내피 세포의 간극을 넒게 만드는 스파이크 단백질의 분자생물학적 특성을 언급하였다. 또한 다시 코로나 감염이 되었을 때 점막에서 IgA 농도가 즉시 올라가지 않는다는 것도 정상적인 분비가 아니라는 근거로 제시하였다.
이 전문적인 논쟁을 언급하는 이유는 특정 논문이 잘못되었다고 지적하기 위함이 아니다. 마지막 논문에 대한 재반박 논문이 다시 나올 수도 있다. 이 논쟁은 단편적인 논문이 대중에게 공개되었을 때의 위험을 잘 보여주기 때문이다. RNA백신, 점막면역, 세포매개면역 등등은 새로운 발견이 매일 쏟아지는 전문 영역이다. 각자 고유의 실험적 기술적 한계들이 존재하는 논문에는 백신에 대한 부정적인 것도 긍정적인 것도 존재한다. 원래는 이런 논문이 쌓이면서 전문가들이 반박에 재반박을 치열하게 거치다 점차 합의에 이른다. 그리고 그 정제된 지식은 교과서에 실리고 대중에게 서서히 공개된다. 그런데 전례가 없는 팬데믹은 전문 연구에 대한 관심을 폭증시켰고, 흥미로운 논문 심지어 동료평가(peer-review)도 끝나지 않은 것까지 대중에게 노출되는 혼란스러운 상황이 일어난 것이다.
직업적으로 전문가들은 새로운 논문을 계속 추적하며 관련 지식을 보정해 나간다. 하지만 이런 추적을 할 수 없는 일반 대중은 우연히 접한 단편적 내용을 확고한 지식으로 가지게 될 위험성이 크다. 따라서 대중에게 제공되는 정보는 특정 주장에 유리한 단편적인 논문이 아니라, 어느 정도 정제가 된 교과서적 지식과 이에 근거한 포괄적인 해석이어야 할 것이다. 앞으로 언론의 정제된 정보의 소통 창구 역할을 기대하면서 이번 글을 마친다.
아래는 2022년 4월 26일 뉴스입니다~
(원문: 여기를 클릭하세요~)
“mRNA가 신약 판도 바꿀 것…더 값싼 혁신 항암제 만들 수 있어”
카탈린 카리코와 화상 인터뷰mRNA 큰 변화 주도
비용 적게 들고 기술 단순
빠른 치료제 개발 길 열어에이즈 백신 등
세상에 없던 약 만들고대상포진 등 고가 백신
가격 확 낮출 수 있어
인류가 코로나19에 반격을 시작한 건 2020년 12월이다. 미국 화이자와 독일 바이오엔테크가 공동 개발한 코로나19 백신 접종이 시작되면서다. 인류를 구한 메신저 리보핵산(mRNA) 백신은 1년도 채 걸리지 않은 유례 없는 속도로 개발에 성공했다. 기존에는 없던 백신 기술이었다. 온갖 수난을 겪으면서도 좌절하지 않고 30년 넘게 연구를 계속해온 한 학자의 노력 덕분이었다. 카탈린 카리코 바이오엔테크 수석부사장(사진)이 그 주인공이다. 한국경제신문은 국내 언론으로는 처음으로 지난 24일 카리코 수석부사장과 화상 인터뷰를 했다.
카리코 수석부사장은 “지금까지 성공하지 못한 후천성면역결핍증(에이즈) 백신 개발은 물론 암과 유전질환 치료도 mRNA 기술을 활용하면 가능할 수 있다”고 했다. 그는 26일 mRNA 백신을 함께 개발한 드루 와이스먼 미국 펜실베이니아대 교수와 국제백신연구소, SK바이오사이언스가 제정한 ‘제1회 박만훈상’을 받았다.
mRNA는 세포가 항원 단백질을 만들 수 있도록 하는 ‘설계도’ 전달자 역할을 한다. mRNA가 전달한 설계도에 따라 만들어진 항원에 대항하도록 몸속에서는 방어 체계가 가동된다. mRNA 코로나19 백신도 이런 원리로 몸 안에서 항체를 형성시킨다.
카리코 수석부사장은 mRNA 기술이 지금까지 인류가 해결하지 못한 다양한 질환을 정복하는 데 활용될 수 있을 것으로 봤다. 그는 “특정 질환의 원인이 되는 유전적 정보만 있다면 이를 RNA 치료제 개발로 연결할 수 있다”며 “겸상 적혈구 빈혈증 같은 유전 질환의 경우 척수에 mRNA를 주사하면 된다”고 했다. 아직 이렇다 할 치료제가 없는 알츠하이머 같은 퇴행성 뇌질환도 mRNA 기술로 치료가 가능할 것으로 예상했다.
그가 mRNA가 다양한 분야에 쓰일 수 있다고 보는 건 기존 치료제 개발보다 장점이 명확해서다. 카리코 수석부사장은 “mRNA 기술은 단순(simple)하고, 빠른 치료제 개발이 가능하다”며 “치료하고자 하는 대상 질환만 정하면 누구나 mRNA 치료제를 만들 수 있다”고 했다. 바이러스 항원을 배양할 필요 없이 mRNA 치료물질만 제작해 넣어주면 되기 때문에 가격도 적게 든다.
그는 아스트라제네카와 모더나가 mRNA 기술로 심부전 치료제 개발에 나선 사실을 언급하며 “(mRNA 치료제 개발이) 트렌드가 됐다”고 말했다. 이처럼 mRNA 활용 범위가 넓어질 것이라는 기대에 전 세계 mRNA 백신·치료제 시장이 2035년 239억달러(약 28조원)에 이를 것이라는 전망이 나온다.

카탈린 카리코 바이오엔테크 수석부사장이 지난 24일 한국경제신문 한재영 기자와 화상 인터뷰를 하고 있다.
카리코 수석부사장은 백신 개발 분야에서 mRNA가 두 가지 큰 변화를 가져올 것으로 예상했다. 첫 번째는 아직 개발되지 못한 감염병 백신 개발 가속화다. 그는 “mRNA를 통해 인류가 갖고 있지 못한 바이러스나 박테리아에 대항할 수 있는 백신을 개발할 수 있다”며 “대표적인 게 에이즈 백신”이라고 했다. 그는 “미국 모더나는 이미 mRNA 에이즈 백신 임상에 들어갔다”고 전했다.
두 번째는 기존에 나온 백신의 대체다. 여기에는 개발 속도가 빠르고 무엇보다 비용이 적게 든다는 점이 고려됐다. 카리코 수석부사장은 “글락소스미스클라인(GSK)의 대상포진 백신 ‘싱그릭스’는 접종하는 데 약 800유로가 든다”며 mRNA 대상포진 백신은 이보다 저렴해 기존 시장의 ‘게임 체인저’가 될 것으로 예상했다. 싱그릭스는 재조합 소단위 항원 보강 재조합 백신으로, 사백신이다.
코로나19 백신 개발로 카리코 수석부사장의 mRNA 연구는 비로소 빛을 봤지만 과정은 고난 그 자체였다. 동료들로부터 “mRNA 백신 개발은 비현실적”이라는 비난을 수도 없이 들어야 했다. 대학에선 연봉 삭감도 당했다. 연구 성과가 시원찮다는 이유에서였다. 설상가상으로 암까지 걸렸다. 그런 절망적 상황에서 그가 30여 년간 연구실로 향할 수 있었던 원동력은 뭘까.
그는 그 힘을 ‘긍정 마인드’로 요약했다. 카리코 수석부사장은 “모든 사람은 스트레스를 받지만, 부정적 스트레스를 긍정적 스트레스로 바꾸는 법을 알아야 한다”고 했다. 부정적 스트레스는 자신을 죽이지만, 긍정적 스트레스는 발전으로 이끈다는 게 그의 생각이다. 카리코 수석부사장은 “‘왜 나에게만?(why me?)’이라는 생각보다 ‘다음은 내가 뭘 해야 하지?(what next?)’라고 생각했다”며 “이미 닥친 현실은 바꿀 순 없기 때문”이라고 했다.
주변에선 자신을 불행 속에서 고군분투한다고 했지만, 정작 본인은 그렇게 생각하지 않았다고 말했다. 카리코 수석부사장은 “주변 사람들이 나를 보고 행복하지 않을 거라고 했지만, 난 진심으로 행복했다”며 “내가 처한 연구 환경이 결코 나쁘다고 생각하지 않았기 때문”이라고 강조했다.
1990년대 헝가리에서 미국으로 이민을 간 덕분에 전 세계에서 가장 뛰어난 연구 결과를 직접 접할 수 있어 불행하지 않았다고 했다. 카리코 수석부사장은 “건설적이지 않은 방식으로 나를 비판하고 재단하는 사람들을 신경 쓰지 않는 법을 배웠다”고 말했다.
아래는 2022년 12월 15일 뉴스입니다~
(원문: 여기를 클릭하세요~)
mRNA, 이제 코로나 넘어 암정복 꿈꾼다…국내 바이오텍 ‘이곳’ 주목

글로벌 제약사 MSD와 모더나의 mRNA(메신저리보핵산) 암 백신 임상 시험이 성공하면서 관련 국내 업체가 주목받고 있다. mRNA 기술이 코로나19(COVID-19) 백신 이외의 분야에서도 성공할 수 있다는 가능성을 처음으로 보였기 때문이다. 에스티팜 등 일부 국내 제약사는 지난해부터 mRNA 암백신을 개발하는 자회사를 설립하는 등 일찍부터 글로벌 트렌드에 대비해왔다.
15일 업계에 따르면 MSD는 최근 mRNA 신항원 암 백신 후보물질 ‘mRNA-4157/V940’의 임상 2b상이 성공했다고 발표했다.
암 백신은 일반적인 백신과 달리 예방이 아니라 수술 후 암의 재발과 전이를 막는 게 목적이다. ‘신항원’은 종양에서 특정 돌연변이가 발생할 때 암세포에서만 발현하는 새로운 단백질이다. 이를 이용한 암 백신이 체내 주입되면 면역세포가 정상세포와 암세포를 구별해 공격하도록 하는 원리다.
mRNA-4157/V940은 올해 10월 MSD가 코로나19 백신으로 유명한 모더나로부터 2억5000만달러(3250억원)를 주고 도입했다. 당시에 임상 데이터가 공개되기도 전이었지만 높은 가격의 거래가 이뤄지면서 업계가 술렁이기도 했다.
MSD의 결정은 성공적이었다. 임상 2b상 결과, mRNA-4157/V940은 면역항암제 키트루다와의 병용 요법에서 단독 요법군 대비 절제 수술을 받은 흑색종 환자의 암 재발·사망 위험을 44% 낮췄다. 심각한 부작용 비율은 14.4%로 단독 요법의 10%와 유사했다. 상세한 데이터는 향후 학회에서 공개되며 내년 임상 3상에 진입할 예정이다.
이번 임상 시험은 mRNA 기술이 코로나19 등 감염 질환이 아닌 다른 분야에서 효능을 입증한 첫 사례다. mRNA는 팬데믹 국면에서 코로나19 백신으로 급부상했다. 그러나 코로나19 백신이 아닌 다른 질환에도 적용할 수 있는지 업계의 우려와 걱정도 있었다. mRNA 암 백신 임상 데이터 공개는 이전에도 몇 차례 있었으나 시장의 기대를 충족할 정도는 아니었다.

국내 바이오기업은 지난해부터 mRNA 암 백신 기술 개발에 나섰다. 가장 진도가 빠른 기업은 에스티팜이다. 에스티팜은 지난해 4월 미국 자회사 ‘레바티오 테라퓨틱스’를 설립했다. 레바티오 테라퓨틱스는 mRNA보다 한 단계 더 진보된 기술로 알려진 원형(Circular) RNA 플랫폼으로 신항원 암 백신을 개발 중이다. 현재 후보물질 발굴, 전임상 단계로 오는 2024년 임상 1상에 진입할 것으로 예상된다.
mRNA는 선처럼 가늘고 긴 모양이다. 원형 RNA는 선의 양 끝이 서로 연결돼 원의 형태를 띤다. mRNA보다 형태가 더 안정적이기 때문에 보관과 정제가 더 편하고, 단백질 발현량도 많다고 알려졌다.
에스티팜 관계자는 “MSD가 두 달 전, 시리즈B 투자 단계에 있던 원형 RNA 플랫폼 기업 ‘오르나 테라퓨틱스’에 약 5조원을 투자했다”며 “원형 RNA는 전 세계적으로 굉장히 뜨는 기술이다”고 설명했다.
에스티팜은 또한 지난해 8월 테라젠바이오와 mRNA 암 백신 공동 개발 업무협약(MOU)을 체결했다. 에스티팜이 5프라임-캡핑(5’-Capping)과 지질 나노 입자(Lipid Nano Particle) 전달 플랫폼 기술을 테라젠바이오에 제공하는 대신 상업화 이후 백신 원액의 위탁개발생산(CDMO)을 담당한다는 내용이다.
아이진도 자회사를 통해 mRNA 암 백신을 개발 중이다. 아이진은 지난해 2월 mRNA 플랫폼 고도화 TF를 사내에 구성하고, 그해 12월 자회사 ‘레나임 테라퓨틱스’를 설립했다. 레나임은 올해 3월 지니너스와 mRNA 기반 췌장암 백신 개발 협약을 맺었다. 모회사인 아이진의 기술 역량을 바탕으로 향후 개인화된 암 백신을 개발한다는 계획이다.
