겨울이 지나면서 낮이 길어지면 더 이상 찬바람에 코가 시리지 않죠. 하지만 날씨가 따뜻해지는 시기에 곤경에 처하는 사람들이 있어요. 그래서 매년 봄만 되면 전쟁을 준비하듯이 의료용 마스크를 구입하고 약을 쌓아놓아야 하죠. 이들은 바로 심한 알레르기를 가진 환자들인데 이들에겐 계절의 변화 자체가 심각한 위협이 될 수 있답니다. 이와 같은 알레르기의 원인은 우리의 면역체계와 관련이 있어요
면역체계의 기본적인 역할은 우리 몸을 위험하지 않게 지켜주는 것이랍니다. 면역 체계에서 가장 중요한 요소는 ‘적응 면역’이라는 반응이에요. 적응 면역 세포들은 문제를 일으키는 바이러스나 박테리아가 다음 번에는 몸 안에 침입하지 못하도록 ‘기억’한답니다. 하지만 가끔은 적응 면역에 문제가 생겨서 엉뚱한 상대를 공격하기도 해요. 그래서 주변 환경에서 볼 수 있는 일부 무해한 물질이나 식품이 알레르기를 유발할 수 있어요.
이 과정에는 적응 면역을 ‘지휘’하는 세포인, B 세포(골수, bone marrow에서 유래)라고도 불리는, B-림프구에서 생산되는 특수한 항체 분자가 관련되어 있어요. B-림프구는 세포 표면의 고유한 모양을 보고 해로운 미생물 등을 인식한답니다. 과학 수사관들이 범죄자의 지문 기록을 가지고 있듯이 B-림프구도 우리가 이미 겪었던 모든 감염에 대한 기록을 필요로 하죠.
항체에 대해서 좀더 자세히 알아볼까요?
항체(抗體, antibody, Ab, immunoglobulin, Ig)는 항원과 특이적 결합을 하여 항원-항체 반응을 일으키는 물질이에요. 혈액의 혈소판은 적혈구와 반응하여 응집하고 태어날 때부터 항상 가지고 있으므로 정상 항체 또는 동종 항체라 하고, 이는 혈액형과 관련이 있어요. 면역 체계에서 세균이나 바이러스같은 외부항원들과 특이적 결합을 하여 항원을 인식하게하고 동시에 무력화시키는 작용을 하는 면역글로불린은 면역 항체라고 하는데 보통 항체라고 하면 면역 항체를 뜻한답니다. 항체와 면역글로불린은 동일한 의미로서 면역글로불린은 항체로서 작용하는 당단백질을 뜻해요. 여러 종류의 면역글로불린이 있는데 이들을 면역글로불린 상과(上科)(immunoglobulin superfamily)로 묶어 분류하고 있어요. 항체는 혈액과 조직액 뿐만 아니라 분비물(눈물 등)에서도 발견되는데 플라즈마 세포에서 생성되고 분비된다고 해요. 플라즈마 세포는 면역계의 B세포가 T세포와의 상호작용하는 가운데 B세포가 특정 항원과 결합하여 분화된 세포이고, 각 항체는 특이적으로 항원과 결합하며 플라즈마 세포에 의한 항체의 생산은 체액성 면역이라고도 불린답니다.
아래의 그림에서 보는 바와 같이, 항체의 기본 구조는 Y자형의 단백질이며, Y자의 위쪽 두 가지에 항원과 결합할 수 있는 특이적 구조를 가지고 있어요. 이러한 특이적 구조는 면역 세포에서 일어나는 DNA 수준에서의 유전자 재배열에 의해 상상할 수 없을 정도로 많은 가짓수를 가질 수 있으므로, 다양한 항원에 대응할 수 있답니다.
항체는 비교적 큰 분자량을 가진 단백질로서 아미노산기에 당사슬이 결합하고 있어요. 대부분의 면역글로불린 상과(上科) 항체들은 아미노산의 N-말단에 결합하고 있지만 IgA1와 IgD 경우만 O-말단에 결합하고 있다고 해요. 각 항체의 기본 단위는 각각 경사슬 2개와 중사슬 2개가 이황화 결합을 하여 이루어진 Y자 모양을 한 단량체 분자이며 단량체가 1- 5개까지 모여 하나의 항체를 구성한답니다.
항체의 컴퓨터 이미지. 소리굽쇠처럼 갈라진 부분 양쪽 끝이 항원과 결합한다.
즉, B-림프구가 만든 항체 분자는 끝이 두 가닥으로 갈라진 소리굽쇠처럼 생겼어요. 항체 ‘소리굽쇠’의 손잡이 부분은 대부분 모양이 거의 비슷해요. 맡고 잇는 서로 다른 임무에 적합하도록 다섯 가지 변종 정도만이 존재할 뿐이지요. 면역 ‘적응’의 특성은 양 끝의 ‘가닥’ 부분에 따라 달라진답니다. 각 B-림프구는 항체의 형성에 관여하는 유전자를 다양한 돌연변이에 노출시킬 수 있기 때문에 항체 가닥의 모양이 다양해져요. 그 결과 여러 가지 형태의 항체를 만들 수 있답니다.
우리 몸속에는 수많은 B-림프구가 있고, 유전자 재조합에 의한 돌연변이로 변형된, 그래서 B-림프구마다 각각 독립적인 항체 유전자를 가지고 있어요. 그래서, 마치 열쇠와 자물쇠의 관계처럼, 감염으로 병원체가 들어왔을 때 병원체 표면의 올록볼록한 부분과 퍼즐 조각처럼 모양이 일치하는 항체가 림프절에 존재할 확률이 높아요. 병원체가 우리 몸 내부로 들어오면 B-림프구는 병원체를 물리칠 항체를 조립할 준비를 하라는 신호를 받아요. 그리고 병원체가 우리 몸에 위험하다는 사실이 다른 면역 세포에 의해 확인되면 B-림프구는 병원체 표면에 더욱 잘 맞도록 항체의 구조를 변경해서 많은 양을 생산한 뒤 혈관, 침샘, 장 등으로 방출한답니다.
어떤 병원체가 우리 몸에 들어왔을 때 항체와 모양이 딱 맞으면 다른 항체들이 금세 몰려와 표면에 달라붙지요. 그리고 면역체계 세포들은 대부분 항체의 ‘손잡이’를 인식해서 ‘잡을’ 수 있어서 병원체와 항체를 같이 잡아먹거나 독소로 감염시켜요. 게다가 비만 세포라는 감시병은 미리 항체를 붙잡고 항체에 병원체가 붙을 때까지 기다린답니다.

알레르기를 잘 일으키는 식품들. 땅콩 등의 견과류나 꿀은 일반적으로 건강에 좋지만, 누군가에게는 생명을 위협하는 ‘독’이 될 수도 있다.
비만 세포는 가려움이나 부어오름, 발진과 같은 알레르기의 주요 증상의 원인이에요. 항체가 붙어있는 비만 세포의 표면에 병원체가 붙으면 비만 세포는 가능한 그 부분을 다른 조직에서 고립시키고 혈관을 막으면서 다른 면역세포들을 가능한 많이 끌어들이기 때문에 부종이 발생해요. 그리고 몰려든 모든 면역 세포는 가려움을 유발하는 물질을 분비하지요.
B-림프구는 침범한 미생물이나 물질을 ‘퍼즐’로 가두는 항체를 생산하기 전에 또 다른 경로로 이 ‘신참’이 정말 위험하다는 확인을 받아야만 한답니다. 항체가 우리 몸에 유익한 물질을 공격할 가능성을 최소한으로 만들 예방책이 필요하니까요.
항체가 어떤 물질의 표면을 붙잡을 때 우리 몸에 해가 있는지 또는 없는지 결정하는 세포는 보조 T 세포(help T cells, 여기서 T는 thymus에서 유래)예요. T-림프구라고도 불리는 보조 T 세포의 주요 임무는 병원균 감염으로 발생한 손상을 분석하고 그에 따른 가장 효과적인 반응을 선택하는 거지요. B-림프구와 함께 우리 몸의 면역체계를 책임지는 든든한 ‘아군’이에요. 보통은요.
만약 우리 몸에 들어온 물질이 조직에 손상을 주지 않으면 보조 T 세포는 활성화되지 않아요. 그런데 알레르기 반응에서는 보조 T 세포가 저절로 활성화되어 항체 생산을 가속화한답니다. 왜 이런 현상이 일어나는지는 아직 명확하게 이해되지는 않았지만, 결과는 분명하지요. 이렇게 너무 많은 항체를 분비시킴으로써 면역체계가 잘못 반응하게 만드는 물질을 ‘알레르기 항원’이라고 불러요. 동물의 털이나 먼지, 식품 성분 등 아주 많은 요소가 알레르기 항원이 될 수 있답니다.
자 이에 세균성 및 바이러스성 질병과 항체에 대한 우리의 과학적인 이해가 어떻게 발전해 왔는지 살펴볼까요?
현미경이 16세기 말에 네덜란드에서 발명되기 전까지, 육안으로는 볼 수 없는 미소 생명체들은 사색과 상상의 영역 속에서만 존재했답니다. 그러던 중, 네덜란드인인 레우벤후크(1632-1723)는 현미경으로 생물을 연구하는 미래의 과학자들에게 엄청난 영향을 미쳤어요. 레우벤후크는 포목상으로 나중에 델프트의 지방 정부 관리가 되었는데, 그의 주된 취미는 렌즈를 만드는 것과 그의 렌즈로 만든 확대경으로 그가 얻을 수 있는 물건이면 무엇이든지 살펴보는 것이었어요. 그의 렌즈들은 유럽에서 가장 우수한 것이었는데, 1673년을 시작으로 레우벤후크는 그의 현미경으로 10년 이상에 걸쳐 수천 종의 물질을 연구했어요. 그는 많은 다른 미생물 종들로 이루어진, 완전히 새로운 미소 유기체의 세계를 발견했답니다.
레우벤후크는 정기적으로 그가 관찰한 사항들을 런던의 왕립학회에 알렸고 왕립학회는 그것들을 출판했어요. 그는 자신이 발견한 것을 지나칠 정도로 세심하게 기록했는데, 예를 들면, 한 보고서에서 그는 자신의 치아 사이에서 채취한 물질의 외양을 기술하면서 “나의 치아는 항상 매우 깨끗하게 유지되지만 그럼에도 불구하고 나는 그것을 현미경으로 관찰 할 때, 그것들 사이에 약간 하얀 물질이 자라고 있는 것을 발견했다. 이 물질에는 아마도 생물체가 있으리라고 나는 판단했다.”라고 썼어요. 자기 자신의 프라그에서 그는 ‘아주 활발하게 움직이는 매우 작은 많은 동물체’를 발견했다는 것인데, 그것들은 물 속에서 매우 빨리 이동했어요. 레우벤후크의 보고 이후에 현미경으로 이 유기체들을 다시 살핀 사람 중에 아무도 그것들이 살아있음을 의심하지 않았고, 레우벤후크의 관찰 결과들은 많은 과학자들에 의해 확증되고 확장되었어요. 완전히 새로운 이 미생물의 세계는 주로 레우벤후크의 취미활동을 통해 세계에 알려졌던 것이죠.
19세기 중엽에는 더 좋은 현미경이 만들어졌고 살아 있는 미소 유기체의 존재가 충분히 확립되었답니다. 그렇지만 당시의 과학자들 중에서 미생물이 질병의 원인이 된다는 것을 믿는 사람은 거의 없었어요. 아마도 큼직한 인간에 도전하는, 눈에 보이지 않는 작은 유기체에 대한 개념은 대다수의 사람들이 믿기에는 너무 억지 같아서 일지도 모르죠.
육안으로 보기에는 너무 작은 생명체의 존재를 과학자들이 받아들이자 그들은 이 미생물들이 발효처럼 당시에는 잘 알려져 있지만 거의 이해가 안되는 과정에 관여하는지 여부를 궁금해 하기 시작했어요. 설탕에서 알코올을, 포도에서 포도주를, 발효된 보리에서 맥주를 만드는데 효모가 필요하다는 것은 수백 년 전에 이미 알려져 있었는데, 당시의 몇몇 과학자들은 “효모가 살아있는 미소 유기체일 수 있을까?”라는 의문을 갖기 시작했답니다.
언급한 ‘발효’라는 현상에 필수적인 것으로 보이는 효모와 같은 작은 ‘물질’을 당시에는 ‘효소’라고 불렸는데(현재는 효소의 의미가 바뀌어서, 세포 내에서 합성되어 소화나 호흡 등, 생체 내에서 행해지는 거의 모든 화학 반응의 매체가 되어 ‘촉매’ 역할을 하는 모든 고분자 화합물을 뜻한답니다.), 19세기 중반에 큰 논쟁 거리 중 하나는 이 효모가 살아있는지 여부였어요. 패러데이(1791-1867)의 스승인 험프리 데이비(1778-1829)를 포함해서 19세기 초에 많은 뛰어난 화학자들은 어떤 화학반응들은 어떤 물질이 그 반응 중에 첨가되면 반응 속도가 크게 증가하지만 이 첨가된 물질은 반응 중에 사라지거나 반응 후에 그 상태가 변하지 않음을 밝혀냈어요. 예를 들면, 녹말은 그것에 황산을 가하고 가열함으로써 당으로 변환될 수 있었지만 황산이 빠지면 녹말은 당으로 전환될 수 없었어요. 그러나 황산은 이 반응 후에 전혀 변하지 않았어요. 녹말이 당으로 전환된 후에도 전환이 일어나기 전과 똑같은 양의 황산이 존재했던 것이죠. 같은 식으로 백금 가루는 반응 동안 자신은 변하지 않으면서도 과산화수소를 물과 산소로 분해했어요. 이러한 연구에 사용된 황산과 백금 그리고 자신은 변하지 않으면서 화학 변화율을 증가시키는 물질을 ‘촉매’라고 불렀어요.
효모는 알코올 발효 과정 중에 소모되지 않지만 발효가 효과적으로 일어나기 위해서 정말로 필요한 것 같았어요. 그 당시의 화학자들은 설탕이 알코올로 전환되는 데 효모가 단지 촉매라고 제안했어요. 효모에 추가하여 몇 가지 다른 효소가 알려졌는데 그 중에 포도주를 식초로 바꾸는 효소가 있었어요. 스웨덴의 베르셀리우스(1779-1848)에 의하면, 이 효소들은 무기적이고, 무생물적인 촉매에 불과했어요. 또 한 사람의 뛰어난 화학자인 독일의 리비히(1803-1873)는 효모가 살아있는 작은 생물일 수 있음을 받아들였지만 여전히 알코올 생성의 원인이 되는 효소는 죽은 또는 죽어가는 효모 유기체가 내놓은 무생물 촉매라고 믿었어요. 효소가 미소 유기체라는 생각을 일반적인 사람들이 받아들이기를 꺼린 것은 부분적으로 그 당시의 화학자들의 견해에서 기인했고, 그래서 교과서들에는 효소가 무생물 촉매라고 적혀 있었답니다.
파스퇴르(1822-1895)가 발효를 연구하기 시작했을 때, 다양한 발효가 알려져 있었고 다른 과정들, 가령 육류 등의 부패는 악취나는 최종 산물을 내는 반응에 관여하는 효소들에 기인한다고 여기지기 시작했는데, 파스퇴르는 주의깊게 설계되고 꼼꼼하게 수행된 실험을 통해 효모와 다른 효소들이 실제로는 미생물임을 세상에 알린 과학자랍니다.
루이 파스퇴르는 1822년에 프랑스의 돌에서 태어나서 화학자로 훈련받았어요. 그의 초기 연구 중에는 그가 발견한 분자 비대칭현상에 대한 연구가 있었어요. 어떤 분자는 왼쪽 장갑과 오른쪽 장갑처럼 두 개가 거울상 형태로 존재하는데, 종종 이러한 두 형태는 화학적으로 식별이 안된답니다. 그런데 두 개의 거울상 형태의 물질은 편광을 회전시키는 성질이 달라서, 한 형태는 반시계 방향으로 그것을 회전시키고 또다른 형태는 시계방향으로 회전시킨답니다. 파스퇴르는 타르타르산 결정이 거울상 형태로 존재하며 두 형태가 반대 방향으로 편광을 회전시킴을 발견했어요. 그는 또한 타르타르산의 형태 중 하나만이 생명체에 의해 물질대사될 수 있음을 입증했어요. 다른 거울상 타르타르산은 생명체에서 전혀 사용되지 않는다는 것이죠. 생명체가 분자의 거울상 형태를 식별할 능력이 있음을 발견한 것은 생화학 체계에 대한 이후의 이해에 큰 영향을 미쳤어요.
파스퇴르는 발효에 대한 실험을 시작하기 몇 년 전부터 발효의 과정에 대해 어느 정도는 알고 있었어요. 그의 효소에 대한 지적 호기심은 어떤 효소가 타르타르산처럼 거울상 분자 형태로 존재할 수 있는 아밀알코올을 만들어 내는 것을 알게 되었을 때 비롯되었는데, 파스퇴르에게 특히 흥미가 있었던 것은 발효 중에 생성된 아밀알코올이 두 가지 가능한 형태 중에서 오직 한 가지 형태만으로 존재한다는 사실이었어요. 그는 보통의 화학 반응과는 달리 살아 있는 세포만이 화학물질의 거울상들을 식별할 수 있다는 것을 알고 있었기 때문에, 파스퇴르는 처음부터 이 결과의 중요성을 인식했고 발효가 살아 있는 유기체에서 기인한다고 확신한 것은 당연하다고 생각할 수 있어요. 그의 효소에 대한 연구가 진행되는 동안, 그 당시의 과학자들이 받아들이기를 거부함에도 불구하고, 파스퇴르는 효소가 살아있는 유기체에서 기인한다고 믿었어요.
파스퇴르의 발효에 대한 실험은 그가 교수가 된지 1년 후인 1855년에 진지하게 시작되었어요. 한 학생의 아버지가 효모를 사용해 사탕무를 알코올로 발효시키는 증류주 제조장을 소유하고 있었는데, 그 과정에 문제가 생겼기 때문에, 그 아버지는 조언을 듣기 위해 파스퇴르를 찾아왔고 파스퇴르는 그가 도울 수 있는지 알아보기 위해 효모를 조사하기로 했어요. 파스퇴르가 현미경으로 효모 알갱이를 관찰하고 발효 과정에서 손상을 입으면 그것들의 모양이 어떻게 바뀌는지 알아차렸을 때, 그는 효모에 대하여 큰 관심을 갖게 되었고, 그는 깊이 있게 발효를 연구하기 시작했어요.
그리고 몇 년동안 파스퇴르는 자세하고도 주의깊게 다양한 효모들에 대한 연구를 수행하였는데, 거기에는 알코올, 젖산, 타르타르산, 낙산(butyric acid)을 만드는 효소들이 있었어요. 그는 우유를 시게 만드는 유산 효소도 발견했답니다. 그것은 효모 알갱이보다 훨씬 작지만 모양은 그와 비슷한 미소 입자로 이루어져 있었어요. 파스퇴르 이전에는 아무도 신 우유에서 미소 물질을 보지 못했는데, 파스퇴르는 유산 효소의 작은 입자를 발견할 정도로 주의깊고 관찰력이 뛰어났어요. 그는 이 입자들을 분리해 냈고 그것들에 의해 우유를 시게 하는 것이 가능함을 입증했으며, 그것들이 다른 점에서도 효모와 매우 유사하게 행동함을 발견했어요.
그가 영양액을 이용해서 효소들을 배양했을 때 그는 그것들이 빠르게 번식하고 그 자손들은 모체를 닮았음을 알아냈어요. 그는 그들의 성장률이 발효의 정도에 비례함도 입증했으며, 그는 또한 양파즙이 몇 가지 효소를 죽이지만 어떤 것들은 죽이지 못하는 것을 밝혀냈어요. 이것이 위대한 과학자의 눈에 살균 방법의 힌트가 된 것은 당연하겠죠? 이 살균 방법은 파스퇴르 연구의 산물이었으며 나중에는 외과 수술 분야에서 혁명을 일으켰어요. 그렇지만 이러한 연구들만으로는 효소가 살아 있다는 개념은 확립되지 못했어요. 예를 들어, 리비히는 효소가 죽어가는 미생물이 내놓는 살아있지 않은 물질이라고 이미 제안했었기 때문이에요.
그러나 파스퇴르가 이후 계속하여 수행한 결정적인 실험들을 통해서 대부분의 화학자들은 효소가 바로 미생물이라는 것을 확신하게 된답니다. 파스퇴르는 먼저 발효가 이전에 생각된 것과는 달리 그렇게 간단한 현상이 아님을 보여주었어요. 예를 들면, 그가 알코올 발효의 생성물을 조사했을 때, 그는 알코올 외에 글리세린, 숙신산 등 알코올과는 다른 화학물질을 발견했어요. 베르셀리우스와 그의 추종자들이 주장한 대로 알코올 발효가 단순한 화학반응을 촉진시키는 화학적 촉매에 기인하는 것이라고 한다면 설탕이나 포도당에서 단순하게 생성될 수 없는 이런 많은 화학 물질들이 어떻게 생성될 수 있는지가 쉽게 설명될 수 없었어요. 파스퇴르는 발효를 통한 생성물의 복잡성을 살아있는 유기체가 이 반응에 책임이 있다는 생각과 연결시켰어요. 그는 또한 발효 중에 생성된 많은 부산물들이 분자 비대칭을 나타내며, 두 가지 가능한 거울상 형태 중에서 오직 한 가지 형태만이 존재함을 발견했어요. 그는 이것을 생명체 개입의 증거로 믿었답니다.
파스퇴르는 설탕, 암모니아, 단순 무기염으로만 만든 배양기에서 효모를 자라게 했을 때, 좀더 중요한 큰 성과를 얻을 수 있었어요. 이런 조건 하에서는 적은 수의 효모 알갱이가 배가할 수 있었고, 그것들은 그 과정에서 배양기의 성분들을 다 사용해 버렸어요. 그것들의 성장률은 알코올의 생성률과 비례했는데, 이러한 발효 현상은 확실히 효모의 분해나 죽음의 결과가 아니었던 것이죠. 즉, 효모 알갱이들의 수는 상당히 증가되고 있었고 알코올 역시 양적으로 증가되고 있었어요. 효모는 배양기에 있는 단순한 물질들을 포획하여 그 물질들을 이용해서 단백질과 효모의 다른 성분을 만들지만, 무생물 촉매는 촉매 작용을 하는 화학 반응 과정 동안 수의 증가가 없는 상태로 변하지 않고 남아 있을 뿐이었어요. 이와 같은 실험 결과들은 효모 알갱이가 살아 있다는 생각과 일치했고 효소의 무기 이론을 주장하는 과학자들과 심각한 논쟁을 불러일으켰답니다.
언급했던 바와 같이, 파스퇴르는 낙산 효소도 발견했어요. 이 효소는 움직이는 한 종류의 미생물로 이루어져 있었는데, 그것은 꿈틀대며 배양기 속에서 재빨리 헤엄쳤기 때문에 의심의 여지없이 살아 있다고 판단할 수 있었어요. 그것의 많은 특징들은 그가 연구 중에 발견한 다른 효소를 특징 지우는 것들과 유사했어요. 파스퇴르는 또한 낙산 효소는 산소가 있을 때보다 없을 때 더 쉽게 수가 증가함을 발견했는데, 이것으로 그는 어떤 유기체가 산소없이 번식하고 왕성히 자랄 수 있다는 것을 밝혀낸 최초의 과학자로 인정된답니다.
파스퇴르의 자세하고도 훌륭한 효소 연구를 통해 발효 과정을 수행하는 미생물의 성장에 요구되는 영양 조건들이 정확하게 확립되었어요. 발효 미생물의 각 유형은 자신만이 선호하는 독특한 산도, 성장 온도, 영양 조건을 갖고 있으며 각각의 효소는 자신의 특징적 산물을 내놓아요. 이러한 효소에 대한 철저한 연구를 통해 다양한 발효 과정에 요구되는 최적 조건의 개발할 수 있게 되는 등 식초, 포도주 및 알코올 산업에 매우 중요한 정보를 제공할 수 있게 되었어요. 일상생활 속에서 파스퇴르의 이름은 우유, 포도주, 다른 음료들과 음식물들 안에서 미생물의 성장을 막기위해 그것들을 가열하는 방법인 저온살균법이란 명칭 속에 살아있는데, 파스퇴르는 이 방법을 1850년대에 포도주 산업에 응용했고, 포도주의 세균 감염을 줄이고 맛과 질을 개선시키는 데 중요한 공헌을 했어요.
한편, 특별한 조건에서 발효 과정이 잘못되는 ‘병’에 걸리기도 한다는 것이 확실해졌어요. 파스퇴르는 이 ‘병’들이 발효 미생물을 감염시키는 다른 미소 유기체의 존재나 발효 미생물이 잘못된 최종 산물을 내놓게 하는 부정확한 성장 조건에 기인함을 인식했어요. 이런 연구를 하는 동안 파스퇴르가 발효 미생물과 인간의 질병 미생물 사이의 연관성을 깨닫기 시작했음은 의심의 여지가 없는데, 특정 유형의 미소 유기체가 특정한 발효와 부패를 수행할 수 있다면, 그리고 다른 미생물이 발효 과정에서 병을 일으킬 수 있다면, 어떤 동물의 병이 특정 유형의 세균의 감염에 의해 야기될 수도 있지 않겠는가라는 질문을 어렵지 않게 할 수 있기 때문이에요.
파스퇴르는 화학으로부터 발효로, 그 다음에는 자연발생 부정에 관한 연구로 멋진 성공을 거두며 나아갔어요. 그 다음으로 발효의 ‘세균이론’을 질병의 ‘세균이론’에 적용하는 것이 그에게는 불가피한 순서였다고 볼 수 있는데, 1862년에 그는 “세균 연구는 동물과 식물의 병과 많은 연관을 가지고 있어서 부패성 질병과 전염병의 탐구에서 첫 단계가 된다”고 썼으며, 그로부터 14년 후에 탄저병 박테리아를 가지고 자신의 실험을 시작하였고 세균이론을 확증했어요.
전염병의 세균이론이 받아들여지기 전에, 병의 원인은 오랜 세월 동안 신비와 오해에 묻혀 있었어요. 어떤 사람들은 병이 타락이나 죄에 대한 징계로 생각했고, 또 어떤 사람들은 땅의 ‘힘’이라는 것이 있어서 이 힘이 제어되지 않을 때 병에 걸리고 병이 퍼진다고 믿었어요. 그리고 어떤 사람들은 병이 ‘나쁜 공기’, 즉 ‘독기’로 생긴다고 믿었는데, 예를 들면 말라리아(‘말라리아’라는 단어는 이탈리아어로 ‘나쁜 공기’를 뜻한답니다.)는 늪에서 올라온 독기 때문에 생긴다고 생각했어요. 살아있는 미세한 유기체로부터 전염병이 생긴다고 생각한 사람은 거의 없었고, 그렇게 생각한 사람들조차도 충분히 결정적인 실험적 증거를 내놓을 수 없었죠.
1836년에 이탈리아의 과학자 바시(1773-1856)는 한 종류의 곰팡이가 견직 산업에 문제를 일으키고 있었던 누에의 병인 백강병의 원인임을 입증했어요. 바시는 백강병에 걸린 누에에 생긴 흰 반점에서 채취한 물질을 건강한 누에에 주입했을 때, 똑같은 병이 유발되는 것을 밝혀냈어요. 그는 그 전염성 물질을 현미경으로 관찰했을 때 그것에 곰팡이가 있는 것을 발견했고, 사람의 질병인 아구창 같은 질병도 곰팡이 때문에 생기는 것이 곧 확실해졌어요.
누에의 병은 파스퇴르에게 실험적 수준에서 전염병과 직접 접촉할 수 있는 최초의 기회가 되었어요. 당시 프랑스의 견직 산업은 전염병으로 황폐화되고 있었는데, 상업적으로 이용되던 누에들이 대량으로 병에 걸려 죽어가고 있었던 것이죠. 1856년에 프랑스 농무부는 누에 전염병 연구 프로젝트를 시작했고 파스퇴르가 그 연구를 이끌도록 선임되었어요. 아무도 누에의 표피에 검은 색의 작은 반점이 생기게 하는 그 병의 원인을 몰랐죠. 파스퇴르는 프로젝트 초기에 세균은 누에의 병과 무관하다고 믿고 그 문제를 연구하기 시작했어요. 전염된 누에와 번데기 그리고 거기서 나온 나방에서 ‘미소 입자’가 발견되었지만 그는 그 병이 단지 누에의 생리적 문제라고 생각했어요. 그러나 몇 년간의 실험 후에 파스티르는 프랑스 견직 산업을 망치는 연화병과 미립자병의 원인으로 미소 유기체를 확인했어요. 그의 실험적 발견의 기초 위에서 그는 그 병을 제거할 최선의 수단에 관하여 견직 산업에서 일하는 사람들에게 조언했고 이로써 프랑스와 유럽의 다른 나라들의 견직 산업에 중요한 기여를 했답니다.
그런데, 파스퇴르의 누에 전염병의 탐구는 더 큰 동물들과 인간에 대한 질병의 세균이론을 실험적으로 확증하기 위한 디딤돌이 되었어요. 1876년에 파스퇴르는 왼편이 마비되는 중풍으로 고통받는 병자였음에도 불구하고 프랑스의 양의 수를 격감시키는 무서운 병인 탄저병에 대한 실험적 연구를 수행하기로 했어요. 10여 년 전에 다른 과학자들이 탄저병에 걸린 양의 피에서 막대 모양의 미소 유기체를 발견했고, 탄저병에 걸린 양들의 피가 건강한 양에 주입되었을 때 탄저병이 유발되는 것이 밝혀지긴 했지만, 이 실험에 대한 논쟁이 있었고 자연발생과 발효에 관한 연구에서처럼 얻어진 결과가 세균이론의 반대자들을 만족시킬 만큼 결정적이지 못했답니다.
파스퇴르가 탄저병에 대한 연구를 시작했을 때, 독일의 의사 로베르트 코흐(1843-1910, 1905년 노벨생리학의학상 수상)는 그 병을 집중적으로 연구하고 있었어요. 코흐는 파스퇴르와 함께 질병의 세균이론을 확증하고 오늘날 우리를 많은 무서운 세균성 질환에서 자유롭게 했다는 인정을 받고 있는 과학자랍니다. 코흐는 탄저병에 감염된 양의 피에서 발견된 미소한 막대를 토기의 피나 토끼의 눈에서 채취한 액에서 키웠어요. 그는 현재 탄저병 바실루스로 알려진 이 막대들을 생쥐에 주입되었을 때 탄저병이 유발됨을 밝혀내었고 감염된 생쥐에서 더 많은 바실루스를 발견할 수 있었어요. 건초 같은 다른 출처에서 채취된 막대 모양의 박테리아는 탄저병을 유발하지 않았는데, 코흐는 이것이 탄저병이 특정한 유형의 바실루스에 의해서 야기되는 것을 의미하는 것으로 올바르게 해석했어요. 코흐는 탄저병 바실루스의 전체 생활사를 밝혀냈는데, 그는 그것들이 나누어 졌을 때 가는 실 모양의 막대를 형성하는 것을 관찰했고, 그것들이 원형구조로 변한 것도 관찰했어요.
피나 눈물에서 탄저병 바실루스를 키움으로써 코흐는 병인성 미생물을 분리하여 그것을 동물체 외에서 배양하는 중요한 진보를 이루었어요. 이제는 세균이 질병을 유발할 뿐만 아니라 그것이 배양될 수도 있고 다른 동물과는 무관하게 대량으로 연구될 수 있음이 확실해진 것이죠. 하지만, 어떤 과학자들은 여전히 코흐의 연구에 비판적이었어요. 그들은 탄저병이 바실루스에 의해서가 아니라 감염된 동물에서 피가 채취될 때 그것과 함께 실려온 다른 인자에 의해 야기되는 것이라고 믿었어요. 파스퇴르는 이 비판에 곧 응답하였고 코흐의 연구 결과가 질병의 세균이론을 확립하도록 보충했답니다. 파스퇴르는 탄저병 바실루스를 변에서 배양했고 최초의 배양액을 계속 묽게 하여 바실루스와 함께 있던 번식하지 않는 오염 인자가 희석되어 빠져버려 하나도 남을 수 없을 때까지 계속했어요. 탄저병 바실루스가 계속해서 자라고 있었던 배양액은 여전히 동물에 강한 감염을 유발했는데, 이것은 실제로 바실루스가 탄저병을 유발하는 것임을 의심의 여지없이 합리적으로 입증했던 것이죠. 더욱이 파스퇴르가 그의 배양액에서 바실루스를 여과시켜 제거했을 때, 그 액은 감염 능력을 상실했어요. 이와 같이 질병의 세균이론이 확립되자 과학자들은 코흐와 파스톼르에 의해 개발된 방법을 사용해 미생물이 탄저병 외의 병을 야기할 가능성을 조사하기 시작하게 된 것이죠.
그리고 질병의 세균이론은 수술의 상처 자리에 있는 박테리아를 죽이기 위한 살균법의 개발로 이어졌어요. 영국 외과의사 리스터(1827-1912)는 부패를 야기하는 미생물에 대한 파스퇴르의 연구에 관해 들었고, 그는 파스퇴르처럼 미소 유기체가 외상에 종종 나타나는 무서운 감염의 원인이 된다고 믿었어요. 19세기 중엽까지 외과 수술은 의학적 문제들의 치료에 있어 마지막 방도라고 생각되었으며, 외과적 개입의 결과로 생긴 감염으로 인한 사망은 예외적인 것이 아니라 당연한 것으로 여겨지고 있었죠. 리스터는 이 감염이 미생물에 의한 것이라면 미생물을 죽이는 화학적 처리를 함으로써 수술에 수반되는 문제들을 줄일 수 있으리라고 추론했고, 1864년에 살균 수술법을 개발했어요. 석탄산 분무기로 거둔 그의 성공은 대단했는데, 그는 수술 이후 감염과 감염에 의한 사망의 발생을 극적으로 줄일 수 있었고, 리스터의 살균 수술법에서 세균이 수술 자국에 접근하지 못하게 하는, 오늘날의 수술실에서 사용되는 엄격한 기준이 나왔답니다.
세균이 질병을 야기할 수 있다는 것이 확실해지고 많은 원인균이 분리되자 몇몇 과학자들은 감염된 동물을 죽이지 않고 미생물만 죽이는 물질이 만들어질 가능성을 고려하기 시작했어요. 리스터의 살균 수술은 벌써 상처의 감염이 세균을 죽임으로써 예방될 수 있음을 예증했고, 19세기 말에는 많은 병들이 비위생적 생활 조건과 관련되어 있고 깨끗한 생활 기준이 많은 전염병을 예방하는 데 도움이 된다는 것이 상당히 확실해졌으며, 천연두라는 병은 벌써 제너(1749-1823)에 의해 개발된 예방접종법의 결과로 대대적으로 정복되고 있었죠. 그렇지만 천연두가 예방접종에 의해 예방되는 메커니즘은 모호하게 남아 있었어요. 세균이론의 확립은 많은 전염병에 대한 백신의 생산으로 이어지게 되는데, 파스퇴르는 이 새로운 백신의 개발에서 주된 역할을 했어요. 그의 백신에 대한 공로에 대해 이야기를 시작하기 전에, 그가 백신 연구를 시작할 때까지의 상황에 대해서 살펴볼게요.
(to be continued…)
The advent and rise of monoclonal antibodies
A 1975 Nature paper reported how cell lines could be made that produce an antibody of known specificity. This discovery led to major biological insights and clinical successes in treating autoimmunity and cancer.
In their 1975 Nature paper1, the immunologists Georges Köhler and César Milstein described the production of monoclonal antibodies of predetermined specificity, each made by a continuously growing cell line that had been generated by the fusion of an antibody-producing cell from an immunized mouse with an immortal cancer cell specialized for antibody secretion. Hearing from César about this work before it was published, on the way to an obscure meeting in San Remo in Italy, I knew immediately that our research field had reached a turning point.
The paper: Continuous cultures of fused cells secreting antibody of predefined specificity
Antibodies were discovered in 1890 by the physiologist Emil von Behring and the microbiologist Shibasaburo Kitasato as protective antitoxins in the blood of animals exposed to diphtheria or tetanus toxin2. Ever since, antibodies have been a major research subject, given their key role in adaptive immunity (specific immune responses against, for example, invading disease-causing agents) and their wide range of specificities, essentially covering the universe of chemical structures. This had stood out from early on as a major genetic puzzle. How can our limited genome encode a seemingly limitless repertoire of specificities? And in medical (and industrial) practice, antibodies have been used ever since their discovery as the basis for serum therapy (the treatment of infectious diseases using blood serum from immunized animals), as diagnostic tools to monitor infectious disease, and in innumerable other contexts.
But antibodies specific for any given molecule (called an antigen in the context of an antibody response) came, with a few notable exceptions, as mixtures of antibodies, produced by thousands of antibody-producing cells in an immunized animal or infected person. Each of these cells produced an antibody of its own kind, so that ‘antibody specificity’ usually referred to the properties of antibody populations rather than those of individual antibodies. The inability to produce molecularly defined, homogeneous antibodies of predetermined specificity was a major hurdle that needed to be overcome.
This changed overnight with Köhler and Milstein’s paper. Köhler had joined Milstein’s group at the MRC Laboratory of Molecular Biology in Cambridge, UK, as a postdoc, to study the mechanism of somatic mutation that operates in antibody diversification. The plan was to use mouse myeloma cells for this purpose. These are tumour cells originating from antibody-secreting immune cells. The cancer immunologist Michael Potter at the National Cancer Institute in Bethesda, Maryland, had shown years before that myelomas could be induced in a particular mouse strain by the injection of mineral oil3. The Milstein team was propagating and fusing to each other cells obtained from cell lines derived from various such tumours. However, the myeloma antibodies were ill-defined in terms of specificity. Could one perhaps fuse antibody-producing cells from immunized mice to myeloma cells, to produce continuously dividing cells that make antibodies specific for the immunizing antigen? To detect such fused cells, an approach offered itself which Köhler had become acquainted with during his PhD at the Basel Institute for Immunology in Switzerland and that had been developed by the institute’s director, Niels Jerne4. This was a simple technique in which cells secreting antibodies in response to, and specific for, sheep red blood cells (SRBCs) can be identified by the formation of a clearance (called a plaque)in SRBC-containing agar plates.
With this, the stage was set for the Köhler–Milstein experiment (Fig. 1). Large numbers of plaque-forming hybrid cells secreting anti-SRBC antibodies appeared when spleen cells from SRBC-immunized mice were fused with myeloma cells. The fused cells had acquired expression of a single type of anti-SRBC antibody from a spleen cell and preserved the immortality and high rate of antibody secretion of the myeloma fusion partner. Myeloma and spleen cells were unable to multiply under the chosen experimental conditions, and the myeloma cells apparently preferred antigen-activated spleen cells over others for fusion, a prerequisite for the striking success of the experiment.
Figure 1 | The production of monoclonal antibodies. Köhler and Milstein’s 1975 Nature paper1 solved the problem of how to generate clones of continuously dividing cells that make antibodies of a known specificity. The ability to generate such monoclonal antibodies revolutionized antibody research and paved the way to clinical advances. The authors injected mice with sheep red blood cells and isolated spleen cells, including those that produce antibodies. Different antibody colours indicate antibodies specific for different molecules (antigens), and produced by different cells. The authors had the idea of fusing antibody-producing spleen cells of limited lifespan with myeloma cells — immortal cancerous immune cells secreting antibodies of unknown specificity. Spleen cells that had been activated upon antigen recognition fused preferentially with the myeloma cells, generating hybrid cells called hybridomas. Unlike unfused cells, the hybridoma cells could grow on the selective agar plates used, and formed colonies of identical cells. Hybridomas that secreted antibodies specific for sheep red blood cells were identified by their ability to destroy such cells when added to the agar, generating a clearance (plaque). These original hybridoma cells made two types of antibody, one that recognized sheep red blood cells and another of unknown specificity.
The fused cells could be cloned and propagated indefinitely as what were later termed hybridomas, producing unlimited amounts of monoclonal antibodies. The first-generation hybridomas secreted two types of antibody: the desired one, plus an antibody of unknown specificity originating from the myeloma fusion partner. But this two-antibody problem was soon solved through the isolation of myeloma lines that had lost antibody expression5,6.
Antibodies against any desired antigen could now be generated, investigated and used as homogeneous molecular entities. In 1984, Köhler and Milstein won the Lasker Award together with Potter, and that same year Köhler, Milstein and Jerne were awarded the Nobel Prize in Physiology or Medicine.
The impact of the Köhler–Milstein paper on biomedical and, specifically, immunological research was dramatic, propelled by scientific developments that occurred around the time the paper appeared. Thus, it became clear shortly afterwards that the variable and constant regions of antibodies are encoded by separate gene segments. Antibody diversity arises when somatic recombination joins gene segments together, and when a subsequent process called somatic hypermutation operates, during the course of the antibody response, on the recombined gene segments encoding antibody variable regions. Together, these mechanisms generate a vast repertoire of antibody specificities, as well as distinct classes of antibody, which mediate their various roles (effector functions) through their differing constant regions.
These insights were accompanied by the explosive development of new molecular and genetic tools that allowed the isolation and manipulation of antibody genes in multiple ways. Together with the hybridoma technology, they fuelled a rapidly growing and still expanding field of investigation, in which basic research on antibody diversification and effector function goes hand-in-hand with the production and engineering of monoclonal antibodies for diagnostic and therapeutic purposes.
In the early days, the production of monoclonal antibodies was entirely based on hybridoma technology and used for two main purposes: to study the somatic evolution of the antibody repertoire and the molecular basis of antibody specificity; and to generate reagents that bind to specific proteins or other molecules expressed by cells of the body or by pathogens. In both cases, completely new insights and technical advances resulted. Thus, affinity maturation of antibodies (the increase of antibody affinity during the course of an antibody response) began to be understood at the molecular level. And the technique of fluorescence-activated cell sorting was revolutionized by monoclonal antibodies, allowing the separation of different cell types at an unprecedented level of specificity and resolution. Recent highlights in this area include approaches allowing gene-expression profiling of single cells that have been characterized by the expression of large arrays of surface-marker proteins through cocktails of DNA-tagged, ‘barcoded’ monoclonal antibodies7.
In medicine, monoclonal antibodies have an ever-increasing role and have generated a multibillion-dollar market, which is expected to grow substantially in the future. In addition to their impact on medical diagnosis, the therapeutic application of antibodies has led to spectacular successes in the treatment of autoimmune diseases and cancer. The 2018 Nobel Prize in Physiology or Medicine was awarded for the “discovery of cancer therapy by [antibody-mediated] inhibition of negative immune regulation”. As often happens in biology, both the mechanisms and the efficient induction of the inhibitory processes underlying this type of immunotherapy are still unclear, with ongoing research providing challenges and new perspectives that are driving the development of monoclonal antibodies against additional targets.
Monoclonal antibodies are also being developed to control infectious diseases — following the concept of protective antibodies that goes back to von Behring and Kitasato. Prevalent diseases such as malaria, influenza and AIDS call for the development of what are termed broadly neutralizing monoclonal antibodies, which, applied individually or in cocktails, might provide broad protection8.
Intensive work in this direction has yielded promising results, including engineering antibody specificity through the substitution of variable domains by ligand-binding domains from non-antibody receptors9. Yet the immune system itself uses similar tricks10 and, by and large, antibody design is still unable to outdo it in terms of generating and selecting antibody specificities11. Nevertheless, the manifold modern molecular, cellular and genetic approaches to selecting and engineering antibodies have had, and continue to have, a tremendous impact on the field, whether by producing partly or fully human antibodies of different classes, making bi-specific or toxin-conjugated antibodies for specific therapeutic purposes, or incorporating antibody variable regions into chimaeric antigen receptors on T cells for use in an anticancer treatment called CAR-T cell therapy.
Monoclonal antibodies are nowadays often generated by isolating or transforming antibody-producing cells taken directly from immunized animals or patients, and transplanting the antibody-encoding genes of these cells into suitable producer cell lines, rather than using hybridoma technology12–14. But they started their spectacular career in 1975, secreted by hybridoma cells in Köhler and Milstein’s SRBC-containing agar plates.
Nature 575, 47-49 (2019)
(원문: 여기를 클릭하세요~)
(원문: 여기를 클릭하세요~)
세포융합기술에 의한 암세포의 치료기전에 대하여
세포융합기술에 의한 암세포의 치료기전에 대하여
제1장 머리말
최근 바이오테크놀러지의 발달로 인하여 유전공학의 기술도 고도로 발전하고 있다. 특히, 세포융합법은 세포 공학의 핵심으로 부상하고 있다. 세포 융합이라는 것은 두 개의 세포를 하나의 세포로 만드는 기술이다. 우선 세포질의 융합이 이우러지고 나중에 핵의 융합도 이루어진다. 세포 융합으로 인하여 융합에 사용되는 2개의 세포와 전혀 다른 즉 형질전환세포가 만들어진다. 특히, 암세포와 정상세포의 융합기술이 이미 개발되었고, 인체면역을 기능을 담당하는 B 세포와 암세포(골수종세포/melanoma cell)와 융합하여 하나의 항원결정기와 결합하는 모노클로널 항체세포를 만드는 기술도 개발되었다.
제2장 세포융합의 작용원리에 대하여
(1) 세포 융합은 바이러스를 이용하거나 계면활성제의 일종인 폴리에틸렌 글리콜(PEG)을 사용한다. 세포 융합은 성상이 서로 다른 2개의 세포를 융합시켜 전혀 새로운 기능을 가진 세포를 만드는 혁신적인 기술이다. 인공자외선에 의하여 불활성(복제능력 내지 증식능력이 없는 )시킨 센다이바이러스를 암세포와 혼합하면 고빈도로 암세포가 융합되는 현상이 나온 것을 계기로 세포 융합기굴이 탄생하였다.
(2) 바이러스 외막에 돌출되어 있는 단백질부분이 암세포의 세포막위에 존재하는 단백질 부분과 접촉하면 단백질의 응집이 일어나 결국 세포막간의 연결이 개시되어 세포막의 결합이 이루어진다. 다시 말해서, 2개의 세포의 지질이중층이 콜로이드분산(micelle) 상태의 하나로 되어 세포질이 합류되어 결국 하나의 세포내에 2개의 핵이 존재하는 세포가 만들어진다. 이를 합성 세포 내지 잡종세포라고 한다. 융합세포는 2개의 세포의 염색체를 동시에 가지고 있기 때문에 2개의 표현형이 발현된다.
제3장 세포융합기술의 단계적 발전에 대하여
세포융합은 처음에는 선다이 바이러스에 의하여 처음 시도되었다. 분자생물학의 발전으로 인하여 체외에서(in vitro) 대량으로 융합세포를 만드는 기술이 나왔다. 바로 폴리에틸렌 글리콜(PEG)을 시험관에 넣고 각 세포를 원심분리기를 통하여 세포 분획을 하여 위 시험관에 넣으면 일단 세포질의 융합이 일나나고 나중에 세포핵의 융합이 일어나 완전히 새로운 형질의 융합세포가 나오는 것이다.
제4장 하이브리도마(hybridoma,융합세포)의 제조원리에 대하여
가. B 세포와 암세포의 융합
(1) 1984년 노벨생리의학상은 면역시스템의 항체제조연구의 업적을 세운 영국 세자르 -밀스타인 박사가 수상하였다. 밀스타인 박사는 시험관(in vitro)에서 장기 배양이 불가능한 항체생산세포(B 세포)와 골수종세포(종양세포/암세포/미에로마 세포)를 융합시키면 특이항체를 반영구적으로 시험관내에서 생산가능한 새로운 종양세포(융합세포)가 만들어진다는 것을 실험으로 증명하였다.
(2) 외부에서 침입하는 항원의 성상이 정해진 것이 아니라 언제나 예측이 불가능하다. 막상 항원이 면역계에 들어오면 비로소 그 항원을 인식하고 면역계는 그 항원과 결합할 수 있는 특이적 수용체를 가진 세포만 증식하게 된다. 즉 하나의 B 세포는 언제나 한 종류의 특이항체만 생산한다. 이에 대하여 융합세포는 정상 B세포의 성상과 암세포의 특성을 모두 가진 것으로 언제나 하나의 항원결정기와 결합하는 대량의 항체를 생산할 수 있다.
(3) 하나의 항원결정기와 결합이 가능한 항체를 단일특이적 항체라고 이를 모노클로널 항체라고 부른다. 기존의 항체를 제작하는 방법은 동물에 항원을 주입하여 혈청을 얻어서 이를 인체에 주입하는 방식이었다. 하지만 동물항청의 경우 항원의 구조가 다수의 항원결정기를 가지므로 이에 대응하는 폴리크로널 항체가 만들어졌다. 이에 폴리클로널 항체는 언제나 다수의 항원결정기를 가진 항원에 대하여 면역반응하게 되므로 항원에 대한 표적공격이 상대적으로 미흡하였다 이에 반하여 융합세포에 의하여 제작한 모모클로널 항체는 체내 침투한 어떤 항원이라도 하나의 항원결정기만 서로 맞으면 바로 결합반응을 일으켜 항원을 무력화시키므로 공격의 정확도가 기존 보다 매우 향상된 항체이다. 이를 미사일 항체라고 부르는 이유가 바로 여기에 있다.
나. HAT 배양과 융합세포의 탄생
증식성이 없고 특정항원에 반응성을 가진 B 세포와 증식성은 있으나 항체 항성이 안되는 변이성 골수성세포(미에로마 세포)를 폴리에틸렌 글리콜을 사용하여 융합시켜 특정항원에 반응하는 항체를 무한히 제조하는 기술이 바로 세포융합기술이다. 융합세포와 비융합세포가 혼재하는 상태에서 의도하는 항체를 생산하는 융합세포(hybridoma)의 증식은 불가능하다. 이에 하이퍼텐신, 아미노테린, 티미딘이 혼합된 배양액에서 융합세포를 배양하면 Hypoxanthine-guanine phosphoribosyltransferase (HGPRT)를 정상적인 B 세포로부터 얻은 융합세포는 HAT배지에서 증식이 가능하게된다. HGPRT는 HPRT1 유전자가 합성하는 효소단백질로서 퓨린 염기 뉴클레오오티드 합성에 중심적인 역할을 수행한다.(the purine salvage pathway.)
제5장 모노클로널 항체의 암치료 응용
(1) 지금 세계 각국에서는 사람의 폐암, 대장암, 위암등 각각 암을 특이적으로 인식하는 모노클로널 항체의 개발이 진행되고 있다. 종양세포 즉 암세포의 세포막 표면의 단백질 구조 일부 부위를 특이적으로 인식하는 모노오클로널 항체를 제작하여 인체 투입하면 항체는 암세포의 세포막의 특정 부위와 결합을 시도하여 그 암세포를 박멸하게 되는 것이다. 통상 암세포는 정상 세포보다 증식속도가 빠르고 주변조직으로 침투하는 무서운 돌파력을 가지고 있는 바, 암세포의세포막의 당고리 함유량은 정상세포보다 더 많아서 이 중 하나의 부위만 인식하는 모노클로널 항체를 제작하면 어마든지 암세포를 공격할 수 있는 것이다.
(2) 융합세포에 의하여 만들어지는 모노클로널 항체는 암진단용으로 각광을 받고 있다. 다른 진단시약의 경우 정상 세포를 공격하는 부작용이 심하였지만 모노클로널 항체의 경우 암세포의 특이적 부위만 정확하게 인삭하여 결합하는 장점을 가지고 있다. 모노클로널 항체는 인체에 들어가서 암세포를 수색하여 암세포의 특이적 항원부위를 인식하여 결합하는 능력을 가지므로 스커드 미사일에 비유된다. 그러나, 모노클로널 항체는 인체에 주입하면 언제나 유효한 것이 아니라 지속적으로 투입하여야 한다. 현재의 연구 수준으로는 암세포를 공격하여 박멸한다고 하여도 암세포를 100% 죽이는 것이 아니라서 궁극적인 암치료 수단이 아니라 보조수단 내지 암진단용으로 사용되고 있다는 점이 그 한계이다.
아래는 2021년 7월 6일 뉴스입니다~
(원문: 여기를 클릭하세요~)
항체치료제 전성시대 열리나
2014년 흑색종 치료제로 FDA가 승인한 키트루다는 그뒤 폐암 치료제로 적용이 확대되면서 본격적인 면역항암제 시대를 연 항체치료제다. 국내에서는 2017년 사용이 승인됐지만 아직 폐암 1차 치료에서는 건보 적용이 안 되고 있다. 머크 샤프 앤 돔 제공
효과가 크고 부작용이 작은 면역항암제가 있음에도 현재 4기 폐암 환자의 1차 치료는 기존 항암제만 써야 하고 이게 효과가 없다는 걸 입증한 뒤에야 2차 치료로 면역항암제를 쓸 수 있다.
안타깝게도 환자 10명 가운데 6명은 1차 치료를 받다가 사망하거나 중도에 포기한다. 폐암 환자가 처음부터 면역항암제를 쓰면 건보 적용이 안 돼 치료비가 1년에 1억 원 가까이 든다. 이 회장은 다행히 허가 이전 임상시험에 참여해 무료로 치료를 받을 수 있었다. 당시 통신지원비는 없던 얘기가 됐지만 그렇다고 건보 적용이 확대되지는 않았다. 이 회장이 말하는 폐암 면역항암제는 ‘기적의 신약’으로 불리는 펨브로리주맙(제품명 키트루다)이다.

1986년 미국식품의약국(FDA)이 처음 항체치료제를 승인한 이래 10번째 신약이 나올 때가지 15년, 50번째 신약이 나올 때까지 29년이 걸렸다. 그뒤 불과 5년 4개월 만에 50개가 추가돼 지난 4월 100번째 항체치료제가 승인됐다. 네이처 리뷰스 약물 개발 제공
국제학술지 ‘네이처 리뷰스 약물 발견’ 7월호에는 지난 4월 미국 식품의약국(FDA)이 100번째 항체치료제를 승인한 걸 계기로 항체치료제의 과거와 현재를 정리하고 미래를 조망하는 장문의 기사가 실렸다. 이에 따르면 2019년 세계 의약품 매출 상위 20개 가운데 9개가 항체치료제로 이들의 매출액을 합치면 무려 750억 달러(약 85조 원)에 이른다. 항체치료제 가운데 1위는 휴미라(국내 4위)로 매출액이 196억 달러에 이르고 키트루다가 111억 달러로 2위다.
흔히 항체치료제라고 불리는 단일클론항체 약물은 1986년 처음 FDA의 승인을 받고 시장에 나왔다. 장기이식거부반응을 줄이는 면역억제제 뮤로모납-CD3(제품명 오르토클론 OKT3)로, 면역계의 T세포의 표면에 있는 CD3 단백질을 항원(표적)으로 하는 항체치료제다. T세포 표면에 오르토클론 OKT3가 달라붙어 작용을 방해해 거부반응을 약화시킨다.
그로부터 8년이 지난 1994년에야 두 번째 항체치료제 압식시맙(제품명 레오프로)가 승인됐다. 혈소판 응집에 관여하는 단백질을 항원으로 하는 항체로 관상동맥의 혈전 생성을 억제해 심장질환 위험성을 낮추는 약물이다. 참고로 이 사이 항체치료제의 성분명 끝에 단일클론항체(monoclonal antibody)의 영문 약자인 ‘mab(맙)’을 붙이기로 합의하면서 이후 약물들은 ‘ㅇㅇㅇ맙’으로 불린다.
지난 2001년 10번째 항체치료제가 승인됐고 29년 만인 2015년 말 50개를 채웠다. 그리고 5년 4개월이 지난 올해 4월 100번째 면역치료제로 자궁내막암 항암제 도스탈리맙(제품명 젬펄리)가 승인됐다. 그 뒤 3개가 추가됐는데, 지난달 승인된 103번째 약물이 현재 약효 여부로 논란이 되고 있는 알츠하이머병 치료제 아두카누맙(제품명 아두헬름)으로 아밀로이드 베타 단백질이 항원(표적)이다.
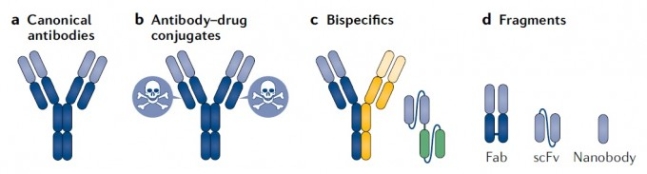
FDA 승인을 받은 항체치료제 100종의 80%는 전형적인 형태(맨 왼쪽)이지만 독한 약물과 결합된 형태(antibody-drug conujugates)(표적 부위로 약물을 데려가는 역할을 한다)와 두 가지 항원을 인식하는 형태(bispecifics), 항원 인식 부위만 있어 덩치가 작아 침투력이 높은 형태(fragments)도 있다. 네이처 리뷰스 약물 개발 제공
리툭시맙은 암세포가 된 B세포 표면의 CD20 단백질을 항원(표적)으로 하고 트라스투주맙은 유방암 세포 표면에 많은 HER2 단백질을 항원으로 하는 항체로 암세포의 증식을 막고 면역세포를 불러들인다. 수많은 암환자의 목숨을 구한 리툭시맙과 트라스투주맙은 지금도 항체치료제 가운데 매출액 5위와 7위에 올라있다.
1998년 크론병 치료제로 승인된 인플릭시맙(제품명 레미케이드)과 2002년 류머티스관절염 치료제로 승인이 난 아달리무맙(제품명 휴미라)은 자가면역질환 항체치료제를 대표한다. 자가면역질환은 면역계가 과잉 반응해 자기 조직을 공격한 결과로 이 과정에 TNF(종양괴사인자)라는 작은 단백질이 면역계의 세포 신호를 담당한다. 따라서 TNF를 항원으로 하는 항체를 만들어 농도를 낮추면 증상을 줄일 수 있을 것이다.
두 약물은 예상대로 약효가 뛰어났고 스테로이드밖에 기댈 게 없던 환자들에게 기적의 신약으로 받아들여졌다. 인플릭시맙은 여전히 항체치료제 8위에 올라있다. 4년 뒤 출시된 아달리무맙은 파지디스플레이라는 신기술로 만든 항체로 약효가 더 뛰어나고 부작용은 더 줄었다. 이 방법을 개발한 업적으로 그레고리 윈터는 2018년 노벨화학상을 수상했다. 선진국에서 자가면역질환 환자가 계속 느는 추세라 아달리무맙은 항체치료제 가운데 압도적인 1위를 달리고 있다.
2014년 피부암인 흑색종 치료제로 승인된 펨브로리주맙(제품명 키트루다)과 니볼루맙(제품명 옵디보)은 둘 다 T세포 표면의 PD-1 단백질을 항원으로 하는 항체로, 3세대 항암제로 불리는 면역항암제 시대를 본격적으로 열었다. PD-1 단백질을 표적으로 함에도 작용 메커니즘은 표적항암제와 전혀 다르다.
암세포는 PD-1과 결합해 T세포가 자신을 공격하지 않게 유도한다. 이때 항체가 먼저 PD-1에 달라붙으면 암세포가 교란작전을 펼 수 없어 T세포의 공격을 받는다. 인체의 면역계를 깨워 암을 치료하므로 면역항암제로 불린다. 항체치료제 매출액 순위에서 펨브로리주맙과 니볼루맙은 각각 2위와 3위에 올라있다. 1990년대 T세포에서 PD-1을 발견한 혼조 타스쿠는 이 업적으로
2018년 노벨생리의학상을 받았다.
승인된 항체치료제 100종을 질환별로 보면 암이 41개로 가장 많고 자가면역질환인 피부병이 9개, 류머티즘이 6개다. 감염질환도 7개로 이 가운데 에이즈와 에볼라 치료제가 있다. 최근 코로나19 치료제도 개발돼 몇 개가 긴급사용이 허가됐지만 아직 정식으로 승인된 건 없다.
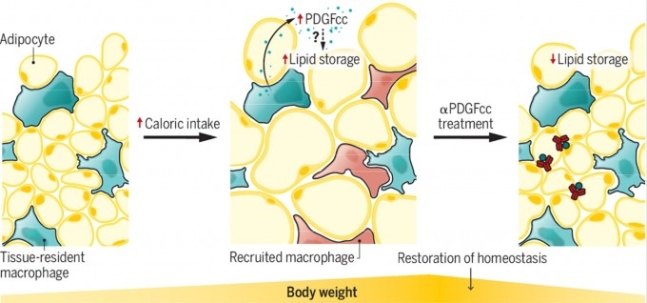
미국 웨일코넬의대 연구자들은 지방조직에 있는 대식세포(tissue-resident macrophage)가 PDGFcc를 내놓아 주변 지방세포(adipocyte)가 중성지방(lipid)을 흡수해 저장하게 한다는 사실을 발견했다. PDGFcc를 항원으로 하는 항체를 만들어 생쥐에 투여한 결과 PDGFcc를 없애 지방 저장이 억제되고 지방 연소가 촉진돼 몸무게가 주는 것으로 밝혀져 비만 치료제 가능성을 보여줬다. 사이언스 제공
지난해 11월 학술지 ‘미국립과학원회보’에는 비만 항체치료제 임상 1상 결과를 담은 논문이 실렸다. 미국의 생명공학회사 제넨테크의 연구자들은 몸의 대사 항상성을 조절하는 호르몬인 FGF21의 기능을 모방하는 항체를 만들었다.
FGF21은 지방세포와 췌장세포, 신경세포의 표면에 있는 수용체인 FGFR1/KLB에 달라붙어 에너지를 소모하고 식욕을 떨어뜨리는 신호를 내보내게 한다. 따라서 외부에서 FGF21을 투여해 비만을 치료하는 시도가 있었지만 몸 안에서 금방 파괴돼 반복적으로 투여해야 하는 문제가 있다.
국제학술지 ‘사이언스’ 7월 2일자에는 지방조직에 상주하는 대식세포가 분비하는 신호분자인 PDGFcc를 항원으로 하는 항체가 비만치료제가 될 수 있다는 동물실험결과가 실렸다. 선천면역계의 구성원인 대식세포는 면역뿐 아니라 다양한 기능을 수행한다.
미국 웨일코넬의대 연구자들은 지방조직에 있는 대식세포가 지방세포의 지방 저장 과정에 적극적으로 관여한다는 사실을 밝혀냈다. 고지방 먹이를 먹은 생쥐의 지방조직 대식세포는 PDGFcc를 내놓고 이를 인지한 주변 지방세포가 중성지방을 흡수해 저장한다.
PDGFcc를 항원으로 하는 항체를 만들어 투여하자 지방 축적이 줄었고 대신 지방을 태우는 열생성이 활성화됐다. 반면 식욕에는 영향을 미치지 않았다. 연구자들은 사람을 대상으로 임상시험을 진행할 계획이다. 머지않아 한 달에 주사 한 방이면 살을 뺄 수 있는 항체 다이어트 시대가 열리지 않을까.
지난 5월 열린 건강보험심사평가원 산하 중증(암)질환심의위원회 회의에서 1차 치료로 키트루다 급여를 인정할지 논의했지만(2017년 이후 여덟 번째다) 결과는 또 심의 보류였다. 제약회사가 가격 조정안을 제시했지만 1차 치료부터 적용하기에는 여전히 건보 재정에 큰 부담이 됐나 보다. 이러다가 특허가 풀려 복제약이 나올 때까지 기다려야 할지도 모르겠다. 참고로 OECD 경제 규모 상위 10개국 가운데 우리나라만 1차 치료 적용이 안 된다. 항체치료제 시대의 혜택을 좀 더 많은 사람들이 누렸으면 하는 바람이다.
아래는 2023년 7월 16일 뉴스입니다~
(원문: 여기를 클릭하세요~)
혈액암 CAR-T 시장 노리는 ADC ‘진론타’[블록버스터 톺아보기]
3차→ 2차 치료제로 확대된 CAR-T ‘예스카타’ 추격
진론타+맙테라 혈액암 1차 치료 병용 임상 2상도 진행
2022년 한 해 동안 진행됐던 ‘블록버스터 톺아보기 파트1’은 3년 전인 2020년 세계에서 가장 많이 팔린 의약품 1~55위를 차례로 다뤘다. ‘블록버스터 톺아보기 파트2’는 지난해 새롭게 10억 달러 이상 매출을 올렸거나 3~4년 내로 그에 상응하는 매출을 올릴 것으로 예상되는 약물을 하나씩 발굴해 다룬다. 이른바 신흥 블록버스터로 떠오른 약물의 탄생과정과 매출 전망 등을 두루 살펴본다.
|
스위스 ADC 테라퓨틱스가 개발한 정맥주사형 거대 B세포 림프종 치료제 ‘진론타’(성분명 론카스툭시맙 테시린)가 지난해 7490만 달러(한화 약 953억원)의 매출을 올렸다. 특히 4분기 매출은 1980만 달러로 전년 동기 대비 16.5% 성장했다.
미국 식품의약국(FDA)이 2021년 4월 거대 B세포 림프종 환자의 3차 이상 치료제로 가속승인한 진론타의 성장세는 올해 급물살을 탈 수 있다는 전망이 나왔다. 지난해 12월 유럽의약품청도 같은 적응증으로 이를 조건부 승인하면서다. ADC 테라퓨틱스 측은 지난 2분기 유럽 파트너사인 소비를 통해 진론타를 출시한 것으로 알려졌다.
항체약물접합(ADC) 기술로 탄생한 진론타는 B세포 표면에 많은 CD19을 타깃한다. 2017년부터 주요국에서 승인되기 시작한 키메릭항원수용체(CAR)-T치료제와 표적하는 부위가 겹치는 것이다. 스위스 노바티스의 ‘킴리아’와 미국 길리어드사이언스의 ‘예스카타’ 등을 포함한 4종의 CD19 타깃 CAR-T치료제가 혈액암 대상 3차 치료제로 초기 적응증을 획득하며 미국이나 유럽연합(EU) 등에서 시판된 바 있다. 특히 최초의 CAR-T 치료제인 킴리아의 재발성 또는 불응성 미만성 거대 B세포 림프종(DLBCL) 임상에서 도출된 완전관해율(완치율)이 30~40%였지만, 진론타의 완전관해율은 61%에 달해 주목받았다.
어밋 말리크 ADC테라퓨틱스 CEO는 올해 초 “진론타 관련 병용요법이나 적응증 확장 시도가 진행되고 있다”며 “연간 매출 잠재력은 5억~10억 달러범위로 증가될 것”이라고 전망했다.
한편 경쟁 약물인 예스카타의 경우 DLBCL이나 B세포 급성 림프구성 백혈병 등의 적응증에 대해 3차 치료제로 승인됐었다. 최근 미국과 유럽 등에서 해당 적응증의 2차 치료제로 각각 지난해 5월과 10월에 확장 승인됐다. 이를 통해 예스카타가 CAR-T 시장을 선도하게 됐다.
ADC 테라퓨틱스 역시 진론타의 매출 확대를 위해 B세포 림프종 관련 1차 치료 적응증을 획득하려 애쓰고 있다. 회사는 스위스 로슈 공동으로 진론타와 ‘맙테라’(성분명 리툭시맙)을 이전에 치료받은 적이 없고 몸상태가 좋지 않은 DLBCL 환자 대상 1차 치료제로 병용투여하는 임상 2상을 진행하는 중이었다.
그런데 이 같은 진론타의 주요 적응증 확대 계획의 차질이 빚어질 전망이다. 지난 14일 ADC테라퓨틱스는 진론타와 맙테라의 병용 임상 2상을 자발적으로 일시 중단한다고 밝혔다. 해당 임상 과정에서 3~5급의 부작용이 발생하면서다. 5급 부작용으로 분류되는 호흡기 관련 환자 사망 7건과 3~4급 수준의 호흡기 관련 이상 사례 5건이 나온 것이다. 항암제 임상에서 부작용은 1~2급은 비교적 경미한 상태를, 그 이상은 심각한 부작용으로 분류하고 있다.
회사 측은 12건의 이상 사례 중 11건이 임상 약물과 관련이 없거나 가능성이 낮은 것으로 평가하고 있다. 또 3~5급의 사례 5건중 4건이 해결됐으며, 임상 계획에 따라 투여를 완료했다고 밝혔다.
말릭 CEO는 “상태 면에서 매우 치료하기 까다로운 환자들에게 진론타와 맙테라의 병용임상이 시도되고 있다”며 “안전을 최우선하며 단계별로 충실히 당국에 보고하면서 임상을 진행할 계획”이라고 말했다.