드디어 RNAi 기반의 약이 FDA 승인을 받았군요^^
(원문)
The US Food and Drug Administration’s decision breathes new life into RNA-interference therapies.
US regulators have approved the first therapy based on RNA interference (RNAi), a technique that can be used to silence specific genes linked to disease. The drug, patisiran, targets a rare condition that can impair heart and nerve function.
The approval, announced by the US Food and Drug Administration on 10 August, is a landmark for a field that has struggled for nearly two decades to prove its worth in the clinic. Researchers first discovered RNAi 20 years ago1, sparking hopes of a revolutionary new approach to medicine. Since then, however, a series of setbacks has lessened those expectations.
“This approval is key for the RNAi field,” says James Cardia, head of business development at RXi Pharmaceuticals in Marlborough, Massachusetts, which is developing RNAi treatments. “This is transformational.”
Patisiran works by silencing the gene that underlies a rare disease called hereditary transthyretin amyloidosis. In that illness, mutated forms of the protein transthyretin accumulate in the body, sometimes impairing heart and nerve function.
The drug’s approval means that pharmacology textbooks will need to be rewritten, says Ricardo Titze-de-Almeida, who studies RNAi at the University of Brasilia. “We are inaugurating a new pharmacological group,” he says. “We will have many more such drugs in the coming years.”
This was the hope when Alnylam, the company in Cambridge, Massachusetts, that developed patisiran, launched in 2002. Four years later, the Nobel Prize in Physiology or Medicine was awarded to two RNAi pioneers: Andrew Fire of Stanford University School of Medicine in California and Craig Mello of the University of Massachusetts Medical School in Worcester.
But to make RNAi into medicine, developers would first need to determine how to deliver delicate molecules of RNA safely to their target organs. They needed a way to shield the RNA from degradation in the bloodstream, prevent it from being filtered out by the kidneys, and allow it to exit blood vessels and spread through tissues. “That proved to be a substantially harder problem than we anticipated,” says Douglas Fambrough, chief executive of Dicerna, an RNAi-focused company in Cambridge, Massachusetts.
As researchers grappled with the delivery puzzle, investors began to lose confidence. In 2008, analyst Edward Tenthoff of investment bank Piper Jaffray in New York City advised his clients to stop buying Alnylam stock. “We saw the promise in the technology, but the delivery was lacking,” he says.
By 2010, large pharmaceutical companies were also losing their appetite for RNAi, severing collaborations and ending internal research programmes. “By and large, big pharma left RNAi for dead,” says Fambrough. Safety concerns dealt the field another blow in 2016, when Alnylam abandoned one of its leading RNAi programmes after finding a possible link to patient deaths in a clinical trial.
But gradually, some RNAi companies began to iron out the kinks in their delivery systems, and Tenthoff started to encourage investors to buy stock again. Alnylam experimented with a number of delivery routes and target organs, encasing some of its RNA molecules in fatty nanoparticles orchemically modifying the RNAs to help them survive the perilous journey through the bloodstream.
RNAs protected in this way and injected into the bloodstream tended to accumulate in the kidneys and liver. This led the company to look at transthyretin, which is produced mainly in the liver. In a clinical trial in 225 people with hereditary transthyretin amyloidosis who showed signs of nerve damage, average walking speed significantly improved in those who received the treatment2. Walking speed declined in the placebo group.
In the future, Alnylam and others will be able to move beyond the liver, says company co-founder Thomas Tuschl, a biochemist at Rockefeller University in New York City. Quark Pharmaceuticals of Fremont, California is testing RNAi therapies that target proteins in the kidneys and the eye. Alnylam is developing ways to target the brain and spinal cord, and Arrowhead Pharmaceuticals of Pasadena, California, is working on an inhalable RNAi treatment for cystic fibrosis.
“I’ve never been more optimistic about the future of RNAi,” says Fambrough. “All of those tear-your-hair-out days were worth it to get to today.”
Advances in RNA delivery might also benefit researchers who are developing gene-editing therapies based on the popular technique CRISPR–Cas9. That system uses a DNA-cutting protein called Cas9, which is guided to the desired site in the genome by an RNA molecule.
Like RNAi before it, CRISPR–Cas9 has become a common tool in genetics laboratories. But it might still face a difficult and lengthy path to the clinic. Much like ordinary drugs, RNAi therapies will break down over time; a gene edit, however, is intended to be permanent, which amplifies concerns about safety.
“I hope they can do it more quickly than we did it, but I would not expect it to be so smooth,” says Fambrough. “I wish them the best of luck.”
Nature 560, 291-292 (2018)
http://dongascience.donga.com/news/view/23400
RNA간섭, 20년 만에 의약품으로 결실 맺다!
매년 10월 노벨과학상 수상자가 발표되면 분야에 따라 반응이 천차만별이다. 지난해 생체시계 같은 경우는 내용이 어렵지 않고 우리가 체험하는 현상이기도 해서 관심이 높았다. 반면 어떤 경우는 그런 분야가 있었는지도 몰랐던지라 어리둥절하다.
2006년 노벨생리의학상이 그런 경우로, ‘RNA간섭(interference)’ 현상을 발견한 생물학자 두 사람이 수상했다. RNA야 DNA와 비슷한 생체분자라고 배운 것 같은데, 사람도 아닌 분자가 뭘 간섭한다는 건지 짐작도 안 된다.
사실 RNA간섭은 1998년 처음 보고된 현상으로 불과 8년 만에 선정된 것이다. 노벨상이 이렇게 빨리 주어지는 건 흔치 않은 일로 그만큼 중요한 발견이라는 뜻이다. 다만 대중에게 미처 알려지기도 전에 노벨상을 받아 이런 반응이 나온 것이다.
RNA간섭이 발견 즉시 높게 평가된 건 유전자의 발현을 조절하는 전혀 새로운 메커니즘인 데다 그 잠재력도 엄청났기 때문이다. 즉 RNA간섭으로 특정 유전자의 발현을 쉽게 조절할 수 있어 많은 아이디어를 실험으로 확인할 수 있게 됐고, RNA간섭 약물을 만들면 의학계의 혁명을 몰고 올 수도 있기 때문이다.
그러나 모든 게 예상대로 되지는 않았다. RNA간섭은 오늘날 생명과학 실험에 일상적으로 쓰이고 있지만 이를 적용한 의약품은 나오지 않고 있다. RNA간섭을 연구하는 많은 벤처에 엄청난 돈을 쏟아부었음에도 별 진전이 없는 걸로 알고 있었다.
그런데 지난 10일 미 식품의약국(FDA)은 최초의 RNA간섭 의약품을 승인한다고 발표했다. 미국의 바이오벤처 앨나이람 파마슈티컬즈(Alnylam Pharmaceuticals)의 파티시란(patisiran. 제품명은 온파트로(Onpattro))을 유전성 트랜스티레틴 아밀로이드증으로 말초신경병증을 앓는 환자의 치료에 사용할 수 있도록 허가했다. RNA간섭 현상을 발견한 지 20년 만에 마침내 RNA간섭이 의학계에 데뷔한 것이다.
현재 앨나이람은 십여 가지 다른 RNA간섭 약물 임상을 진행하고 있고 다른 여러 회사들도 수십 가지 임상을 진행하고 있다. 파티시란 승인을 계기로 머지 않아 RNA간섭 의약품이 쏟아져 나올 것으로 보인다. 아울러 RNA간섭 농약도 출시가 머지않았다. 의학과 농업에 큰 파장을 미칠 것으로 보이는 RNA간섭에 대해 알아보자.

pixabay 제공
예상치 못한 결과 나와
1953년 DNA이중나선이 밝혀진 뒤 과학자들은 DNA의 염기 서열 정보가 어떻게 단백질의 아미노산 서열로 번역되는지 밝히는 연구에 뛰어들었다. 그 결과 DNA가 먼저 같은 염기순서인 단일가닥 전령RNA(mRNA)로 전사된 뒤 리보솜에서 mRNA를 읽어 번역이 일어난다는 사실을 규명했다.
이 과정을 들여다보면 어렵지 않게 한 아이디어가 떠오른다. mRNA의 염기서열과 상보적인 서열의 RNA 단일가닥을 만들어 넣어주면 mRNA에 달라붙어 이중가닥을 만들고 결국 번역이 일어나지 못할 것이다. 아미노산의 정보, 즉 의미를 지닌 mRNA를 센스(sense)라고 부르고 여기에 상보적인 RNA를 안티센스(antisense)라고 부른다.
1980년대 이 아이디어를 확인하는 실험이 진행됐고 정말 안티센스RNA가 어느 정도 유전자 발현을 억제하는 것으로 밝혀졌다. 그러나 후속 실험들에서 결과가 들쑥날쑥했고 심지어 센스RNA(mRNA의 일부분과 서열이 같은 조각)를 넣어줘도 비슷한 효과가 나타나는 등 이해가 안 되는 결과가 이어졌다.
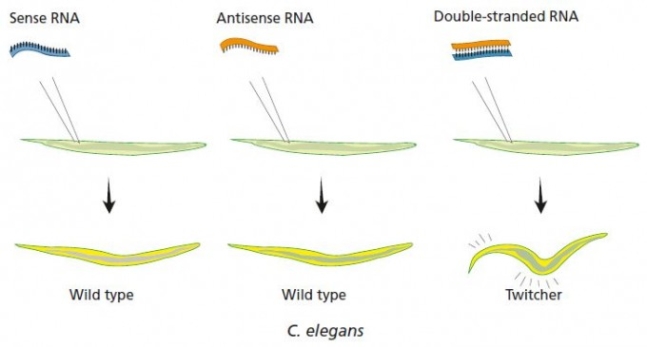
미국 카네기연구소의 앤드루 파이어와 매사추세츠대 크레이그 멜로는 이 혼란을 정리하기 위해 체계적인 실험을 설계해 진행했다. 즉 여러 유전자에 대해 안티센스와 센스, 그리고 둘 다를 넣어 발현 억제 정도를 비교하기로 한 것이다. 기존 이론에 따르면 안티센스RNA를 넣어준 시료에서만 효과가 있을 것이다.
그러나 누구도 예상하지 못한 결과가 나왔다. 센스는 물론 안티센스도 효과가 없거나 미미한 반면 둘을 다 넣어준 시료에서는 단백질이 거의 만들어지지 않는 강력한 효과가 나타났다. 센스와 안티센스를 같이 넣어주면 자기들끼리 먼저 달라붙어 RNA이중가닥을 만들 텐데 어떻게 이게 mRNA에 작용할 수 있을까.
더 이상한 건 세포 안에서 만들어질 mRNA보다 훨씬 적은 양을 넣어줘도 이런 효과를 보인다는 것이다. 이는 기존의 ‘1:1 대응 메커니즘’, 즉 안티센스RNA 분자가 mRNA 분자에 달라붙어 못쓰게 한다는 가정이 틀리다는 얘기다. 이를 설명하려면 넣어준 RNA가 촉매처럼 스스로는 소모되지 않은 채 상보적인 mRNA를 계속해서 파괴한다고 볼 수밖에 없다. 따라서 연구자들은 이 과정에서 뭔가 복잡한 시스템이 동원된다고 주장했다.
이 연구결과를 담은 논문은 1998년 2월 19일자 ‘네이처’에 실렸고 지금까지 1만7000회 가까이 인용된 ‘전설’이 됐다.
1998년 학술지 ‘네이처’에 발표한 논문에서 앤드루 파이어와 크레이그 멜로는 표적 유전자와 같은 서열인 RNA(센스)나 상보적인 서열인 RNA(안티센스)는 발현 억제 효과가 거의 없고 RNA이중가닥이 효과가 크다는 사실을 발견했다. 그림은 unc-22유전자를 대상으로 한 결과로, RNA이중가닥을 넣어 발현이 크게 떨어진 결과 예쁜꼬마선충이 경련을 일으킨다. – 노벨제단 제공�
새로운 유전자 발현 조절 시스템
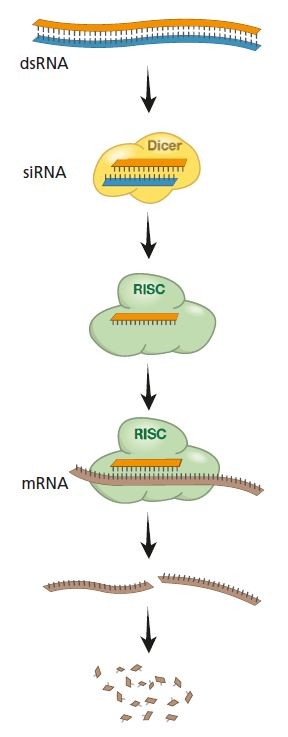
파이어와 멜로를 비롯해 연구자들은 후속 연구를 통해 이 시스템의 실체를 밝히는 데 성공했다. 즉 세포 안으로 RNA이중가닥이 들어오면 다이서(Dicer)라는 단백질복합체에서 염기 20여 개 길이로 잘린 뒤 또 다른 단백질복합체인 RISC에서 단일가닥(안티센스)만 남는다. 여기에 표적이 되는 mRNA가 지나가다 걸리면 이를 분해하는 반응이 일어나 mRNA가 파괴된다. 즉 짧은 RNA단일가닥이 가이드 역할을 하는 셈이다. 그렇다면 왜 이처럼 번거로운 RNA간섭 시스템이 존재하는 것일까.
파이어는 바이러스에 대한 방어시스템일 수 있다고 제안했다. 즉 RNA이중가닥 게놈을 지닌 바이러스가 침투했을 경우 다이서가 바이러스 게놈을 처리해 RISC가 안티센스 조각을 지니고 있으면 바이러스의 mRNA를 파괴해 증식을 억제할 수 있기 때문이다.
그런데 이보다 5년 앞선 1993년 발견된 마이크로RNA(miRNA) 역시 동일한 시스템을 이용해 작동한다는 사실이 밝혀졌다. miRNA는 생명체가 자신의 유전자 발현을 조절하기 위해 만들어내는 RNA간섭이었던 셈이다. 2000년대 초 RNA간섭의 실상이 드러나면서 생명과학이라는 조각퍼즐의 상당 부분이 한꺼번에 맞춰졌기 때문에 2006년 서둘러 노벨상이 주어진 것이다.
RNA간섭은 생명과학 실험에 큰 영향을 미쳤다. 즉 어렵지 않게 특정 유전자의 발현을 80~90%를 억제할 수 있게 되면서(이를 유전자 녹다운(knockdown)이라고 부른다) 그 유전자의 기능을 규명할 수 있게 됐기 때문이다. 특히 유전자를 아예 고장 내면(이를 녹아웃(knockout)이라고 부른다) 생물이 발생과정에서 죽을 경우 그 기능을 알 방법이 없는데(무척 중요할 것임에도), 녹다운이 큰 도움이 됐다.
2000년대 초 RNA간섭의 대략적인 작동 메커니즘이 밝혀졌다. 이에 따르면 RNA이중가닥에서 mRNA에 상보적인 단일가닥이 RISC에 결합돼 RISC가 표적인 mRNA를 파괴하는데 가이드 역할을 한다. – 노벨재단 제공
약물전달시스템 개발이 관건
아울러 많은 사람들이 RNA간섭의 임상 적용으로 관심을 돌렸다. 바이러스나 암의 유전자나 유전질환을 일으키는 변이 유전자를 표적으로 한 RNA간섭 약물이 나온다면 의학계에 혁명을 몰고 올 수 있기 때문이다.
1970년대 인트론(유전자에서 단백질의 아미노산으로 번역이 되지 않는 부분)을 발견해 1993년 노벨생리의학상을 받은 필립 샤프는 동료 과학자들과 투자자들을 끌어모아 2002년 바이오벤처 앨라이람을 설립했다. 이들은 RNA간섭의 잠재력을 높이 평가하고 연구에 뛰어들었는데 얼마 못 가 난관에 부딪혔다. RNA이중가닥을 표적이 되는 세포까지 보내는 게 생각보다 어려운 일이라는 사실이 드러났기 때문이다.
RNA는 설사 이중가닥일지라도 꽤 불안정한 물질이고 혈액에는 이를 인식해 파괴하는 효소가 있기 때문에 그대로는 약물로 쓸 수 없다. 바이러스 캡슐에 집어넣어(게놈 조각의 형태로) 표적이 되는 세포가 있는 조직을 감염시키는 방식도 문제가 많다.
결국 RNA이중가닥을 잘 감싸서 표적이 되는 조직에 갈 때까지 파괴되지 않게 만드는 약물전달시스템 개발에 RNA전달 약물의 미래가 걸려있다는 사실이 분명해졌다. 지난 10년 동안 앨라이람을 비롯해 RNA간섭 약물을 개발하는 벤처들은 숱한 시행착오를 거치며 이 연구를 해왔고 이번에 앨라이람이 마침내 RNA간섭 신약 승인을 받은 것도 제대로 작동하는 약물전달시스템를 개발한 덕분이다.
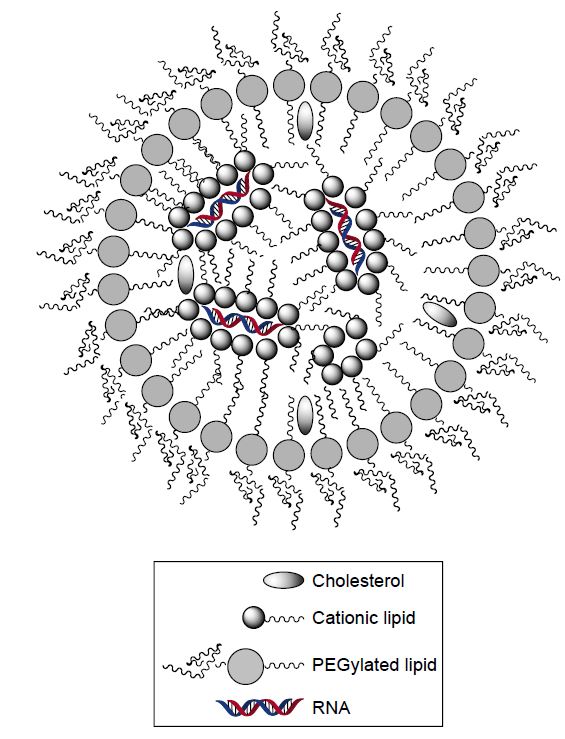
간단히 설명하면 RNA이중나선을 ‘지질나노입자(lipid nanoparticle)’ 안에 넣는 약물전달시스템이다. 즉 표면이 음전하인 RNA이중나선을 양전하인 지질 분자로 감싼 뒤 이를 다시 표면처리된(인체의 면역반응을 피하기 위해) 지질로 감싸 지름 50~100나노미터 크기의 나노입자로 만든 것이다.
RNA간섭 약물의 최대 걸림돌은 표적이 되는 세포까지 RNA이중가닥을 보내는 약물전달시스템을 찾는 일이다. 생체(혈액) 효소 시스템으로부터 RNA이중가닥을 보호해야 할 뿐 아니라 면역계의 표적이 되지 않아야 하고 세포에 흡수된 뒤에는 해체돼 안의 약물(RNA이중가닥)이 방출돼야 한다. 10여 년의 고투 끝에 찾아낸 유력한 약물전달시스템인 지질나노입자의 구조다. 이번에 승인을 받은 파티시란도 이 시스템을 이용했다. – ‘나노의학국제저널’ 제공
아직은 그림의 떡이지만
이번에 승인을 받은 RNA간섭 약물 파티시란은 변이 트랜스티레틴(transthyretin)의 mRNA를 파괴해 세포 내에 변이 트랜스티렌스 단백질이 축적되지 못하게 해 약효를 낸다. 이게 쌓이는 아밀로이드증(amyloidosis)은 세계에 환자 수가 5만여 명인 희귀병으로 발병하면 수년 내 사망한다. 즉 간에서 만들어진 변이 트랜스티레틴 단백질이 여러 조직에 축적돼 말초신경병증 등을 유발한다.
파티시란은 3주 간격으로 투약하는데 앨라이람이 제시한 약값으로 계산하면 1년 치료비가 무려 35만 달러(약 4억 원)에 이른다. 투약을 끊으면 다시 변이 단백질이 쌓이므로 결국 평생 투약해야 한다는 말인데 갑부가 아닌 다음에야 감당이 안 되는 수준이다(의료보험이 적용되면 달라지겠지만).
하지만 앞으로도 RNA간섭 약물이 이처럼 ‘그림의 떡’일 가능성은 낮다. 여러 업체에서 약물이 나오기 시작하고 제조시스템이 최적화되면 값은 빠르게 떨어질 것이다. 필자는 개인적으로 변이 유전자 질환 치료제보다는 항바이러스제나 항암제 쪽을 더 기대하고 있다.
이들이 변이를 일으켜 RNA간섭 약물에 내성을 갖게 돼도 그에 대응해 RNA의 염기서열만 바꿔주면 쉽게 극복할 수 있기 때문이다. 이는 단백질을 표적으로 하는 약물에서는 구현될 수 없는 이점이다.
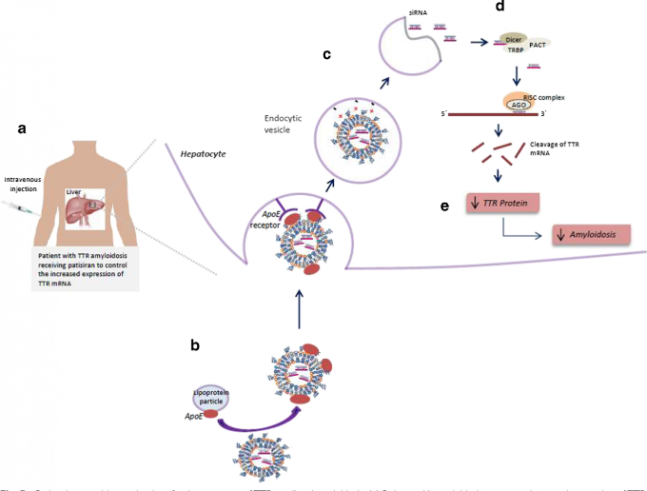
유전성 트랜스티레틴 아밀로이드증 치료제인 파티시란의 작동 메커니즘을 도식화한 그림이다. 파티시란을 정맥투여하면(a) RNA이중나선이 들어있는 지질나노입자가 혈관을 타고 다니다 표적인 간세포로 들어간다(b. 나노입자 표면에 ApoE 단백질을 붙여 간세포 표면의 ApoE 수용체에 달라붙게 했다). 세포 안에서 나노입자가 해체되며(c) RNA이중가닥이 빠져나와 다이서에서 가공된 뒤 표적인 변이 트랜스티레틴(TTR) mRNA와 상보적인 단일가닥이 RICS에 결합돼 TTR mRNA를 파괴한다(d). 표적인 변이 트랜스티레틴(TTR) mRNA와 상보적인 단일가닥이 RICS에 결합돼 TTR mRNA를 파괴한다(d). 그 결과 변이 단백질이 축적되지 않아 아밀로이드증이 개선된다(e). ‘Pharmaceutical Research’ 제공
농약 내성 극복할 대안으로 떠올라
한편 앨라이람은 지난 2012년 거대 농약회사 몬산토와 10년짜리 협약을 맺어 RNA간섭 농약을 개발하고 있다. 오늘날 농약, 즉 살충제와 제초제는 내성이라는 위기를 맞고 있다. 즉 아무리 약을 쳐도 해충이나 잡초가 잘 죽지 않는다.
이에 대한 대응으로 해충의 유전자를 표적으로 한 RNA가닥을 만들어 살충제로 쓴다는 전략이 부상했다. 인간세포에 RNA조각을 넣는 일은 꽤 까다롭지만 절지동물의 경우는 RNA를 먹이면 장에서 쉽게 흡수되는 것으로 밝혀졌기 때문이다. 농작물에 농약을 치듯 RNA조각이 든 물을 뿌려주면 식물이 뿌리로 흡수하고 이를 먹은 해충이 RNA간섭으로 죽게 된다.
RNA간섭이 기대를 받는 이유는 특정 염기서열을 표적으로 하기 때문에 다른 생물체에 해를 끼칠 가능성이 낮기 때문이다. 또 해충이 내성을 획득할 경우 변이에 맞춰 RNA가닥을 새로 만들면 되므로 해충으로서는 죽을 맛이다.
앨라이람과 몬산토는 꿀벌의 해충인 진드기(학명 Verroa destructor)와 유채를 공격하는 벼룩잎벌레를 표적으로 하는 RNA간섭 살충제를 개발하고 있는데 2020년 시장에 나올 것으로 예상하고 있다. 한편 또 다른 거대 농약회사인 신젠타는 콜로라도감자잎벌레를 대상으로 RNA간섭 살충제를 개발하고 있는데 역시 2020년 출시를 목표로 하고 있다.
RNA간섭이 의학과 농업에 얼마나 큰 파장을 불러일으킬지 기대가 크다.
http://www.sedaily.com/NewsView/1S4O8I1RHV
특정 유전자 발현 자체를 억제
희귀질환 치료제로 무한 가능성
진원생명과학, 기술 이전 계약
올릭스도 美서 개발책임자 영입
리보핵산(RNA)으로 질병 발현 유전자를 원천 차단하는 RNA 간섭(RNAi) 치료제가 차세대 바이오의약품으로 주목 받으면서 국내 바이오벤처들이 신약 개발에 뛰어들고 있다. 이들 RNAi 치료제는 단백질을 통해 질병 유발 인자를 제거하는 기존 바이오의약품보다 한 단계 더 발전한 형태로 질병 유발 인자 자체가 활성화되지 못하도록 RNA 차원에서 제거하는 기술이다.
진원생명과학은 17일 “미국 휴스턴 매소디스트 병원 연구소와 mRNA 백신설계 및 연구기술을 이전받는 독점적 라이선스 계약을 체결했다”고 밝혔다.

이 회사 박영근 대표는 “이번 계약을 통해 DNA 백신 및 치료제 뿐 아니라 mRNA 백신 및 RNA 치료제에도 진출하게 됐다”며 “핵산 기반 의약품 전문기업으로 시너지효과를 창출하겠다”고 덧붙였다.
신약개발기업 올릭스도 이날 보스턴 바이오메디컬 출신 웨이 리 최고개발책임자(CD0)를 영입했다고 전했다. 웨이 리 CDO는 보스턴 바이오메디컬에서 11년간 부사장으로 활동했던 경험을 바탕으로 올릭스의 사업개발을 담당할 예정이다. 이에 앞서 이동기 올릭스 대표는 지난 7일 “곧 RNAi 신약(OLX10010)의 국내 임상 2상을 진행할 것이며 예정대로 개발 절차가 이뤄지면 2022년에 신약을 출시할 수 있을 것”이라 밝혔다.
RNA는 DNA와 함께 단백질의 설계도 역할을 맡는다. 외부의 충격에 안정적인 DNA와 달리 RNA는 미세한 환경 변화에도 변이가 일어나기 쉽다. 중동호흡기증후군(MERS·메르스)을 유발하는 코로나바이러스(MERS–CoV)와 같은 병원성 바이러스들은 이런 허점을 이용한다. 우리 몸에서 만들어내려는 설계도에 바이러스가 원하는 물질을 끼워 넣어 숙주의 몸을 감염하고 다른 숙주로 바이러스를 전파한다. RNA간섭은 이러한 과정을 ‘간섭’해 바이러스가 기대하는 단백질을 막는 방법이다. 체내에 주입하는 것만으로 특정 유전자의 활성을 막아 질병을 치료할 수 있다.
RNA 기반 치료제는 단백질에 작용하는 기존 바이오의약품과 달리 단백질 생성 이전 단계에 영향을 미치는 만큼 기존 기술로 표적이 불가능했던 신약 개발이 가능하다. 아울러 치료제가 개발된 지 얼마 되지 않은 만큼 발전 가능성이 무궁무진하다. RNA 간섭 현상을 이용한 최초의 치료제인 앨나이람 파마슈티컬즈의 ‘온파트로’는 지난달 10일 미국 식품의약국(FDA) 허가를 받았다. RNAi 기반 기술을 갖춘 국내 기업으로 올릭스 외에도 올리패스, 바이오니아 등이 있다. 바이오니아는 특발성 폐섬유화증 및 폐암 치료제를 전임상중이다. 올리패스는 통증치료제 ‘SCN9A’를 개발 중이다.