(원문)
DNA-cutting enzyme used for genetic modification can create large deletions and shuffle genes.
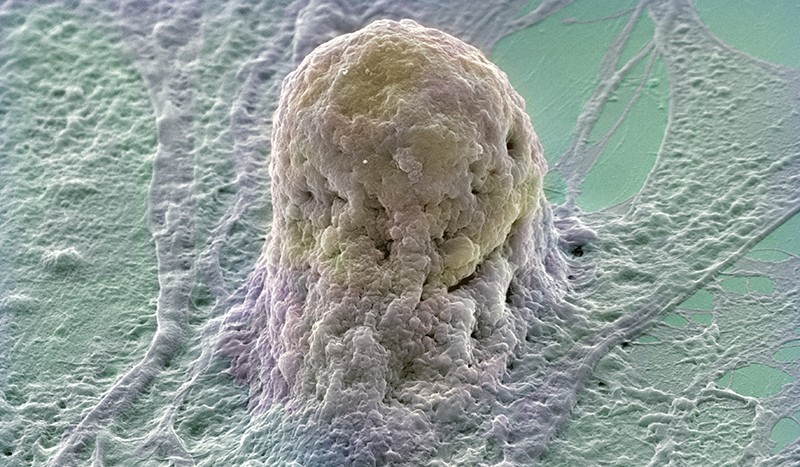
Gene-editing experiments with human embryonic stem cells revealed the imprecision of the CRISPR-Cas9 system.Credit: Annie Cavanagh via Wellcome/CC BY NC
Researchers have embraced CRISPR gene-editing as a method for altering genomes, but some are cautioning that unwanted DNA changes may slip by undetected.
The tool can cause large DNA deletions and rearrangements near its target site on the genome, according to a paper published on 16 July in Nature Biotechnology1. Such alterations can muddle the interpretation of experimental results and could complicate efforts to design therapies based on CRISPR.
The finding is in line with previous results from not only CRISPR but also other gene-editing systems2. Such unwanted edits are a problem that warrants more attention from researchers says Patrick Hsu, a bioengineer at the Salk Institute in La Jolla, California. “I do think this has been underappreciated by the field,” he notes.
CRISPR -Cas9 gene editing relies on the Cas9 enzyme to cut DNA at a particular target site. The cell then attempts to reseal this break using DNA repair mechanisms. These mechanisms do not always work perfectly, and sometimes segments of DNA will be deleted or rearranged, or unrelated bits of DNA will become incorporated into the chromosome.
“The cell will try to stitch things back together,” says mouse geneticist Allan Bradley of the Wellcome Sanger Institute in Hinxton, UK, who led the study. “But it doesn’t really know what bits of DNA lie adjacent to each other.”
Researchers often use CRISPR to generate small deletions in the hope of knocking out a gene’s function. But when examining CRISPR edits, Bradley and his colleagues found large deletions — often several thousand DNA letters long — and complicated rearrangements of DNA sequences in which previously distant DNA sequences were stitched together. The phenomenon was prevalent in all three of the cell types they tested, including a kind of human cell grown in the laboratory.
Quality control
Many researchers use a method for amplifying short snippets of DNA to test whether their edits have been made. But this approach might miss larger deletions and rearrangements, says James Haber, a molecular biologist at Brandeis University in Waltham, Massachusetts.
The deletions and rearrangements should occur only with gene-editing techniques that rely on DNA cutting, not with some other types of CRISPR modifications that avoid cutting DNA, notes Hsu. A method called base editing, for example, uses a modified CRISPR system to switch one DNA letter for another without cutting DNA. And other systems use inactivated Cas9 fused to other enzymes to turn genes on or off, or to target RNA.
Some scientists are already on the lookout for large deletions. At eGenesis, a company in Cambridge, Massachusetts that is using gene editing to engineer pig organs for transplant, researchers routinely look for both large and small deletions using a number of methods, says Luhan Yang, the company’s co-founder and chief scientific officer.
Similarly, at Intellia, another firm in Cambridge that is developing CRISPR–based therapies, scientists have looked for large deletions in gene-editing studies in mouse livers. So far they have found no evidence of such deletions, says senior vice president Thomas Barnes. This, he says, may be because the cells his team works with do not divide often. Bradley and colleagues’ study, by contrast, used actively dividing cells.
Overall, these unwanted edits are a problem that deserves more attention, but this should not stop anyone from using CRISPR, says Haber. “It means that when people use it, they need to do a more thorough analysis,” he says. “It’s generally important to know whether your mutations are as you think they are.”
http://www.yonhapnews.co.kr/bulletin/2018/07/16/0200000000AKR20180716142400017.HTML?input=1195m
英 연구진 “크리스퍼 유전자가위, 예상 못한 변이 유발 가능성”
김진수 IBS 단장 “변이 발생 과정 불명확하지만 주의 깊은 관찰 필요”
유전체 내 특정 유전자를 정확하게 제거 또는 교정할 수 있어 암 등 난치병 치료에 큰 기대를 모으고 있는 크리스퍼 유전자가위(CRISPR–Cas9)가 예상치 못한 변이를 유발할 가능성이 있다는 연구결과가 나왔다.
영국 웰컴 생어 연구소 앨런 브래들리 박사팀은 17일 국제학술지 ‘네이처 바이오테크놀로지'(Nature Biotechnology)에서 크리스퍼 유전자가위를 이용한 쥐 줄기세포와 인간 망막상피세포 실험을 통해 표적 유전자 주변의 염기가 수천개 단위로 결실되거나 재배열되는 오류가 낮은 빈도로 일어난다는 사실을 확인했다고 밝혔다.
크리스퍼 유전자가위는 교정하거나 제거하고자 하는 유전자의 DNA를 인식할 수 있는 특정 염기서열의 RNA 조각을 ‘가이드’로 사용해 유전체 내 표적 위치를 정확하게 찾아 DNA를 염기 가닥을 잘라낼 수 있다.
이를 질병 치료에 활용하면 이론적으로 유전질환을 일으키는 유전자나 돌연변이를 하나만 정확히 잘라내거나 교정하는 것이 가능하다는 의미다. 실제로 현재 미국과 중국에서는 암과 인간면역결핍바이러스(HIV) 감염, 유전질환 등 다양한 질병에 대한 임상시험이 진행되고 있다.
크리스퍼 유전자가위의 장점은 실험 결과 목표하지 않은 위치의 염기를 잘라내는 것과 같은 오류가 비교적 적어 안정성이 높다는 점이다. 크리스퍼 유전자가위는 대체로 표적 밖에 있는 작은 크기의 염기를 제거하거나 삽입하는 정도의 오류를 일으키는 것으로 알려져 있다.
브래들리 박사팀은 그러나 쥐 배아줄기세포와 인간 망막상피세포에 크리스퍼 유전자가위를 적용한 이번 연구에서 지금까지 알려진 것과 달리 크리스퍼 유전자 가위가 표적 주변의 염기 수천개를 잘라내거나 재배치하는 오류를 일으킨다는 사실을 확인했다.
연구진은 이는 크리스퍼 유전자가위가 교정하고자 하는 표적 유전자뿐만 아니라 주변의 다른 유전자들이나 유전자 발현 등을 조절하는 조절 염기서열에도 영향을 미쳐 세포 기능 변화를 초래할 가능성이 있음을 보여준다고 지적했다.
기초과학연구원(IBS) 유전체 교정연구단 김진수 단장(서울대 화학부 겸임교수)은 이 연구결과에 대해 “연구진이 표적 주변에서 대규모 염기 결실 등이 일어날 수 있음을 확인했으나 어떻게 이런 변이가 발생하는지는 불명확하다”며 “유전자 녹아웃 방식으로 질병을 치료하는 경우에는 이런 오류가 크게 문제 되지는 않을 것 같지만, 주의 깊게 관찰할 필요는 있다”고 말했다.
그는 또 네이처 바이올로지 논평에서 “연구진이 크리스퍼 유전자가위 등을 체세포·생식세포 유전자 치료법에 적용하기 위한 안전 기준을 높였다”며 “향후 임상시험에서 이런 방법이 표적 외 염기에 미치는 영향은 물론 표적 내 염기에 미치는 영향도 주의해 살피고 제어해야 한다”고 강조했다.