(원문: 여기를 클릭하세요~)
[과학발전이 낳은 ‘장수사회 빛과 그림자’]
장수 유전자 복제·늙은 세포 제거술·생체 이식 등
의료기술·신약 진화···이론상150세까지 생존 가능
나이는 숫자에 불과한 시대 현실로 다가오지만
젊은 피 수혈’ 주사 한 번 맞는데만 900만원 들어
‘有錢長生 無錢短生’ 갈수록 수명격차 양극화 우려

“인류의 최대 수명은 115세를 넘기 어렵다.”
지난 2016년 미국의 앨버트아인슈타인의대 연구팀은 과학학술지 ‘네이처’를 통해 이 같은 연구 결과를 발표하며 세계의 주목을 끌었다. 연구를 이끈 얀 페이흐 박사는 약 40개국의 생존율과 사망률을 분석한 결과 “장수하는 사람이 늘고 있는 것은 사실이지만 110세를 기점으로 인구 증가세가 멈춘다”고 주장했다. 극단적으로 오래 산 534명을 분석해도 115세 이상 사는 사람은 드물었다며 인간 수명의 한계가 그즈음이라는 결론을 도출한 것이다. 해당 연구는 과학자들 사이에서 “억지스러운 연구” “연구방법론이 잘못됐다” 등의 거센 반발을 불러일으켰지만 아직 쉽게 반박되지 못하고 있는 것도 사실이다. 예를 들어 1997년에 122세로 사망한 프랑스 잔 칼망의 최고령 기록이 20년이 지난 현재도 깨지지 않는 것이다.
단, 이는 인간의 자연수명에 관한 이야기다. 세계 과학계에는 인위적인 방법으로 인간 자연수명의 한계를 뛰어넘을 수많은 연구가 진행되고 있다. 아직은 대부분의 연구가 동물실험 단계에 그치고 있지만 과학계는 이런 도전들이 언젠가 지금 태어나는 아이들을 150세까지 살 수 있도록 하는 해법이 될 것으로 기대하고 있다.
◇노화 억제제부터 젊은 피 수혈까지···‘불멸’을 위한 도전=인류를 더 건강하고 오래 살게 하겠다는 것은 생명공학의 궁극적인 목표다. 생명연장의 꿈을 이루기 위한 과학자들의 노력은 본격화됐는데 대표적으로 늙은 세포를 제거함으로써 젊음을 되찾게 하는 연구를 들 수 있다. 인간 몸속의 세포는 일정 시간이 지나면 세포분열이 멈추도록 프로그래밍돼 있는데 이를 ‘헤이플릭 한계(Hayflick Limit)’라고 한다. 분열이 멈춘 세포는 몸속에 계속 남아 일을 하지만 젊은 세포보다는 일을 못해 인체 곳곳에 고장을 일으킨다는 것이다. 미국 메이오클리닉 연구팀은 이런 원리에 착안해 분열이 정지된 늙은 세포를 제거한다면 인체의 노화 문제를 해결할 수 있을 것으로 봤다. 실제로 연구팀이 2016년 2월에 발표한 연구에 따르면 생후 360일 된 생쥐의 노화세포를 제거하며 건강상태를 측정한 결과 일반 쥐가 626일 산 반면 세포를 제거한 쥐는 843일을 살았다. 수명이 30% 늘어난 것뿐만 아니라 늙은 쥐의 운동력과 활동성이 증가하는 등 ‘진짜 젊음’을 되찾았다는 것이 연구팀의 결론이다. 김채규 울산과학기술원(UNIST) 화학과 교수 연구팀도 노화세포를 제거하는 약물을 퇴행성 관절염에 걸린 실험용 쥐에 투여한 결과 관절염 증상이 사라지고 건강한 상태가 오래 유지됐다는 사실을 밝혀 주목을 받았다. 김 교수가 발견한 노화세포 제거 신약 물질은 미국 스타트업인 유니티바이오테크놀로지에 기술이 이전돼 연구개발이 이어지고 있다.
젊은 피를 수혈해 젊음을 되찾겠다는 시도 역시 비슷한 맥락이다. 젊은 피는 수사학적 표현이 아닌 진짜 ‘피’다. 미국 UC버클리대의 이리나·마이클 콘보이 부부는 혈액을 교환함으로써 인체 노화 시계를 거꾸로 돌릴 방법을 찾기 위해 10년여간 연구를 진행하고 있다. 지난해 11월에 발표된 최신 연구는 생후 3개월 된 어린 쥐와 23개월 된 늙은 쥐의 혈액을 절반씩 교환하는 내용을 담고 있는데 결과는 역시 긍정적이었다. 늙은 쥐가 혈액 교환 하루 만에 젊어지기 시작해 5일째에는 손상된 근육까지 회복되는 결과를 얻은 것이다.
이 밖에도 약물로 노화 작용을 억제함으로써 수명을 연장하는 시도가 이뤄지고 있다. 노화를 촉진하는 활성산소를 제거해 젊음을 되찾아준다는 식이보충제 등이 같은 맥락이다. 장수한 사람들에게는 특별한 유전자가 있을 것이라는 점에 착안해 장수 유전자를 찾아 이식함으로써 더 오래 살게끔 하겠다는 아이디어나 고장 난 인체의 장기나 조직을 무균돼지 등의 장기와 교체함으로써 노화 증상을 막겠다는 연구도 다방면으로 진행되고 있다.
◇첨단 노화 연구로 ‘수명 격차’ 심화 우려도=과학자들의 노력으로 인류의 오랜 꿈인 장수의 실현이 가까워지는 것은 사실이지만 이런 미래가 ‘장밋빛’일지에 대해서는 이견이 많다. 숱한 노화 방지책들이 동물이 아닌 인간에게도 통할지, 부작용은 없을지에 대한 과학적·윤리적 문제는 차치하더라도 결국 이 같은 첨단 기술의 수혜가 부유한 사람들에게만 돌아갈 것이라는 불안이 커지는 것이다.
일례로 젊은 피 수혈로 젊음을 되찾아준다는 아이디어는 미국의 생명과학 기업 ‘암브로시아’에서 수년 전부터 인체를 대상으로 한 실험을 진행하고 있는데 참여자가 막대한 비용을 감수해야 한다. 알려진 바로는 16~25세 젊은이들에게 추출한 혈장·혈액 주사를 한 번 맞는 데만 900만원 정도가 든다.
굳이 미래로 눈을 돌릴 필요도 없이 선진국과 개발도상국 간의 수명 격차 심화는 현재 진행형이다. 미국 중앙정보국이 244개 국가의 기대수명을 조사한 결과에 따르면 2016년 기준 스위스·이탈리아·프랑스·독일 등 대다수 유럽 국가와 미국·캐나다 등 북미의 기대수명은 평균 80세가 넘지만 가봉·콩고 등 아프리카대륙 내 국가들의 기대수명은 60세를 채 넘기지 못하고 있다. 무작정 늘어난 수명이 노후비용을 높여 오히려 노년의 삶을 비참하게 만들 수 있다는 지적도 나온다. 학계의 한 관계자는 “일부만 혜택을 보는 최대 수명 연장 연구에 과학적 자원을 쏟아붓기보다는 누구나 건강하고 행복하게 오래 사는 기간을 뜻하는 ‘건강수명’ 연구에 초점을 맞추는 것이 더 중요하고 의미가 있을 수 있다”고 말했다.
아래는 2022년 11월 19일 뉴스입니다~
(원문: 여기를 클릭하세요~)
나는 얼마나 살까? DNA에 숨은 비밀
큰아이가 어릴 때, 과학체험 수업에서 물고기 관찰을 했다며 작은 플래티 한 마리를 데려왔습니다. 이 작은 물고기를 키워보고 싶다는 아이의 반짝이는 눈을 외면할 수 없었습니다. 결국 난생처음 어항을 꾸미고 플래티의 친구로 거피 몇 마리를 들였습니다. 거피를 고른 이유는 그저 값이 싸고 손이 덜 간다는 주변의 조언 때문이었지요. 하지만 당시는 몰랐습니다. 그때 시작한 물고기 기르기가 지금까지 10년 넘게 지속될 것을 말이죠.
그간 어항 속 물고기는 여러 번 세대를 거듭했습니다. 어항 속 생태계를 통해 아이들은 탄생과 죽음의 과정을 자연스럽게 보며 자라났습니다. 알을 낳는 대부분의 물고기와 달리 거피는 난태생으로 번식합니다. 암컷의 몸 안에서 알이 부화해 치어가 태어나는 것이죠. 통통하게 부풀어 올랐던 암컷 거피의 배가 홀쭉해졌다 싶으면, 겨우 속눈썹 크기 정도로 작은 치어들이 헤엄치는 모습이 관찰됩니다. 하루하루 시간이 흘러, 처음에는 너무 작아 속이 들여다보일 만큼 투명하던 치어는 점차 커지고 그 몸피에도 알록달록한 색이 자리잡습니다.
그렇게 치어의 성장을 살피다보면 문득 어항 구석에 있는 나이 든 거피가 눈에 띕니다. 체구는 아이 손가락만큼 커졌지만, 새끼를 여러 번 낳아 등이 굽고 몸빛이 탁해져 수초 그늘에 숨듯 자리를 잡고 더는 헤엄치지도 먹이를 먹으러 수면 위로 올라오지도 않은 채, 아가미만 뻐끔거리는 늙은 암컷 거피 말입니다. 그런 모습이 눈에 띄면 때가 됐다는 생각이 듭니다. 그런 녀석들은 며칠 뒤면 어김없이 허연 배를 드러내고 물 위로 떠오르거든요. 어항 속 환경을 아무리 쾌적하게 유지하려 애써도, 거피는 때가 되면 그렇게 한 마리씩 숨을 다하고 떠오릅니다. 여전히 탄생과 죽음은 생명체의 피할 수 없는 운명이라는 듯 말이죠.
아이들은 어항에서 개체 각각은 탄생하고 자라고 죽어가지만, 어항 속 개체수는 일정 수준을 늘 유지한다는 생태계 규칙을 저절로 학습했고요.
2013년 미국 로스앤젤레스 캘리포니아대학(UCLA)의 유전학자 스티브 호바스는 저널 <게놈 바이올로지>(Genome Biology)에 흥미로운 논문 한 편(참조1)을 게재합니다. 인간 세포에서 추출한 디엔에이(DNA)에는 개체를 발생시키는 다양한 유전물질의 정보뿐 아니라 그 세포 주인의 나이를 아는 지표도 숨어 있다는 것이었지요. 그가 주목한 것은, 각각의 유전자 기능을 조절하는 역할을 하는 일종의 스위치인, ‘DNA 메틸화’(DNA methylation) 유형이었습니다.
아무리 키가 크고 건장한 사람이라도 그 기원을 거슬러 올라가면, 하나의 난자와 하나의 정자가 결합해 만들어진 단 한 개의 세포, 즉 수정란에서 시작합니다. 이후 수정란은 발생을 거듭하면서 인체를 구성하는 약 37조 개, 200여 종의 세포로 분화합니다. 분화한 각각의 세포는 모두 수정란이 분열해 생겼기에, 각각 생긴 모습과 하는 일은 전혀 달라도 DNA 정보는 같습니다. 이들의 차이는 DNA 정보의 차이가 아니라, 그 속에 든 유전자의 선택적 발현 차이입니다.
이는 마치 똑같은 책을 100권 준비하고 각자 다른 페이지를 펼친 뒤, 나머지 페이지는 열지 못하게 풀로 단단히 붙여버리는 것과 비슷합니다. 이 100권의 책은 모두 동일한 내용을 담고 있지만, 독자는 어떤 책을 고르느냐에 따라 정해진 페이지밖에 볼 수 없는 거죠. 각자 역할을 가지고 분화한 세포에서도 이런 일이 일어납니다. 우리 몸의 세포는 피부세포든 위장세포든 혈구세포든 모두 동일한 유전정보를 가졌지만 각자의 역할에 필요한 유전자만 활성화하고 나머지는 발현이 막혀 있습니다. 또한 해당 세포에서 필요한 유전자라 하더라도 때와 환경조건에 따라 일시적으로 발현을 멈춰야 할 때도 있습니다.
DNA는 여러 방법을 사용해 적재적소에 필요한 유전자만이 발현되도록 조절하는데, 그 유전자 조절 스위치 중 하나가 메틸기(—CH3)라는 화학분자입니다. DNA에 메틸기가 붙으면, 마치 자물쇠로 잠근 것처럼 해당 부위의 유전자 발현이 정지됩니다. 반대로 메틸기가 떨어지면, 마치 자물쇠가 풀린 것처럼 유전자 발현이 일어납니다. 이처럼 DNA에 메틸기를 붙여 유전자 발현을 조절하는 것을 ‘DNA 메틸화’라고 하죠. DNA 메틸화는 고정불변하는 것이 아니기에, 환경조건에 따라 그 빈도와 정도가 달라집니다. DNA 메틸화를 조절하는 요인 중 하나가 바로 이 세포 주인의 나이입니다. 나이 들면 세포 내 DNA 메틸화 유형이 변화합니다.
호바스 박사는 서로 다른 연령대의 사람 몸에서 채취한 표본 1만3천 개 이상의 DNA를 조사 분석해, 나이에 따라 DNA 메틸화가 변하는 유형을 찾아냅니다. 그가 찾아낸 방법을 이용하면, 세포의 DNA 메틸화 유형을 조사하는 것만으로도 이 표본 제공자의 나이를 1.5~3.6년 오차범위 내로 추정할 수 있습니다. 가까이에서 얼굴과 몸 전체를 요모조모 뜯어봐도 대략 20대 혹은 40대로밖에 나이를 추정할 수 없다는 사실에 미뤄본다면, DNA에 이토록 정확하게 우리 나이가 기록돼 있다니 놀라울 따름입니다. 호바스 박사가 발견한 DNA 속 나이 추정법은 일명 ‘호바스 시계’(Horvarth’s clock)라고 하며 이후 각종 연구에 활용됩니다.
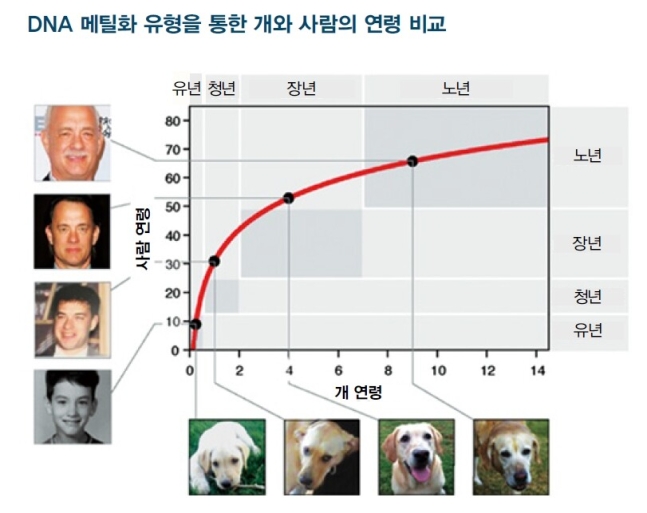
호바스 시계에서 DNA 메틸화 정도는 나이를 반영하며, 일정한 나이가 되면 그 개체의 겉모습이 어떻든 상관없이 일정한 형태를 보입니다. 이를 동물에게 적용하면 개체의 연령 발달 정도를 알 수 있습니다. 2020년 미국 연구진은 호바스 시계 기법을 개에 적용해 개의 연령에 따른 발달 정도(참조2)를 알아냅니다.
이에 따르면, 개는 탄생 직후 급격히 성장해 성인이 되고 이후 노화 속도가 점차 느려짐을 알 수 있습니다. 생후 1년 된 개에서 나타난 DNA 메틸화 유형은 사람이라면 31살 정도에서 나타나는 형태와 비슷합니다. 갓 태어난 강아지의 몸은 겨우 1년 만에 사람이면 서른 해 동안 겪을 변화를 다 겪는다는 것이죠. 이 속도로 늙어간다면 개는 채 몇 년 살지 못할 것입니다. 다행히도 개의 DNA 메틸화 변화 속도는 점차 느려집니다. 이를 비교해보면 개의 2살은 사람의 42살, 12살은 70살에 대응될 만큼 느리게 변화합니다. 개는 초기 발달 속도가 엄청나게 빠른 대신 성장한 어른의 몸으로 천천히 늙어가는 셈이죠.
호바스 시계에서 나타나는 DNA 메틸화를 조사하던 학자들은 이 메틸화 유형을 이용하면 생물체의 수명을 추적할 수 있다는 데 생각이 미칩니다. 오스트레일리아 연구진은 개체의 수명 혹은 생존에 영향을 주는 유전자 42종을 골라, 이 부위의 메틸화 유형 변화를 살핍니다. 만약 어떤 유전자의 발현이 그 세포의 생존에 필수적인데 이 부위가 메틸화돼버리면 세포는 생존이 어려울 겁니다. 반대로 특정 유전자는 발현하면 오히려 생존에 해가 될 수도 있습니다. 이 경우 이 부위의 메틸화는 굳건히 유지돼야 살아남는 데 유리하지요.
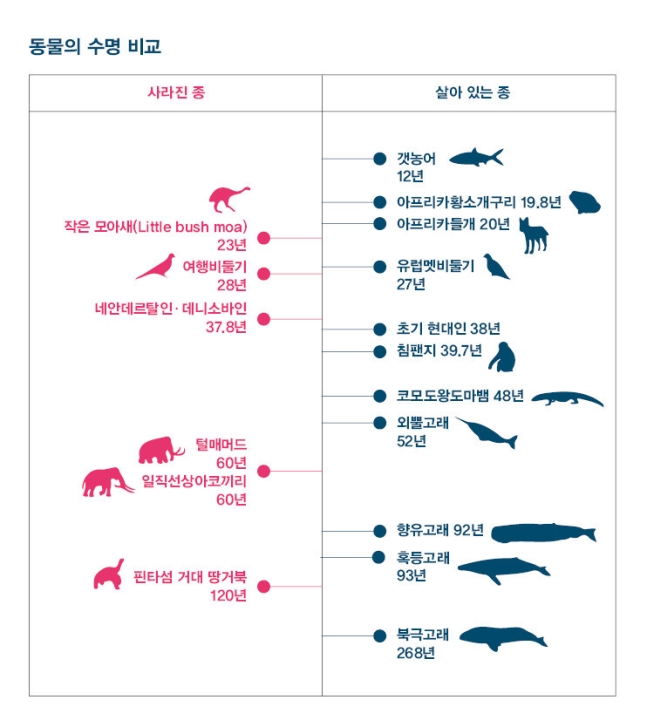
연구진은 충분한 유전체 정보가 확보된 척추동물 252종에서 DNA 메틸화 유형의 분석을 통해 이들의 자연수명을 추정합니다. 이 연구(참조3)에 따르면 DNA 메틸화 유형의 분석 결과 갯농어(Milkfish)의 자연수명은 12년, 아프리카들개는 20년, 침팬지는 39.7년으로 추정됐습니다. 이 수치는 기존 동물 집단의 관찰 결과로 얻어진 수명 자료와 비슷했기에 이 방식을 이용한다면 수많은 동물의 자연수명을 예측하는 것이 가능합니다. 또한 이 방법은 오로지 유전정보만을 이용하기 때문에 이미 멸종한 동물의 DNA로도 가능합니다. 그래서 우리는 멸종동물인 여행비둘기(28년)와 털매머드(60년)가 얼마나 살았는지를 알 수 있지요. 생물의 수명부는 저승사자의 명부책이 아니라 우리 자신의 DNA에 아로새겨진 셈입니다.
이들의 연구에서 눈에 띄는 것은 우리네 직계 조상인 초기 인류(호모사피엔스)와 동시대에 살았던 친척 인류인 네안데르탈인의 결과입니다. 두 인류 모두 DNA에 나타나는 정보의 특성만 파악해보면 자연수명이 40살 남짓밖에 되지 않습니다. 우리의 생물학적 몸이 구석기시대 호모사피엔스의 그것에서 크게 변화하지 않았다는 것에 비하면, 우리는 주어진 시간의 두 배 이상을 거뜬히 살아내는 셈입니다.
영국 생태학자 조너선 실버타운의 저서 <늙는다는 건 우주의 일>의 이야기를 빌리면, 어쩌면 노화에 얽힌 비밀을 푸는 진짜 열쇠는 ‘우리는 왜 이것밖에 못 사는가‘가 아니라, ‘우리는 왜 이토록 오래 사는가’를 밝히는 것에 있을지도 모릅니다. 인류는 어떻게 자연수명보다 훨씬 더 오래 살 수 있게 됐을까요? (그 이야기는 다음 칼럼에서 이어가겠습니다.)
참조
1. Steve Horvath, ‘DNA methylation age of human tissues and cell types’, vol 14(2013), gb-2013-14-10-r115”>https://genomebiology.biomedcentral.com/articles/10.1186/gb-2013-14-10-r115
2. Tina Wang, etc ‘Quantitative Translation of Dog-to-Human Aging by Conserved Remodeling of the DNA Methylome’, (2020), https://www.cell.com/fulltext/S2405-4712(20)30203-9
3. Benjamin Mayne, ‘A genomic predictor of lifespan in vertebrates’, vol 9(2019), https://www.nature.com/articles/s41598-019-54447-w